Нейротоксичность NMDA-антагонистов
Нейротоксичность NMDA-антагонистов (англ. NMDA receptor antagonist neurotoxicity, NAN) — термин, описывающий повреждения мозга, вызванные диссоциативными анестетиками, в особенности неконкурентными блокаторами канала NMDA-рецептора. В их число входят кетамин, фенциклидин и декстрометорфан. Ярким примером NAN при избыточном использовании NMDA-антагонистов являются «лезии Олни» (англ. Olney’s lesions, от англ. lesion [ˈliːʒ(ə)n] «повреждение, поражение»).
В медицине NMDA-блокаторы играют роль анестетиков, и агонисты ГАМКA-рецепторов эффективно предотвращают различные проявления их нейротоксичности. В число таких защитных средств входят также антихолинергические препараты.
История исследования
В 1989 году Джон Олни с соавторами осуществили эксперимент, в ходе которого крысам вводились большие дозы экспериментального диссоциатива MK-801. При последующей проверке в мозге у грызунов обнаружились крохотные пустоты, вакуоли, преимущественно в постериорной поясной извилине и ретроспленальной коре. В зонах вакуолизации скапливалась микроглия и белок Hsp70, с формированием необратимых повреждений.
Роланд Ауэр провел схожие исследования с целью изучить зависимость поражения от возраста и пола животных, и показал, что с увеличением возраста смертность крыс от блокировки NMDA-рецептора повышается, а у самок крыс всех возрастов более выражена гибель нейронов[1].
Закись азота, широко применяемая на людях, особенно при лечении зубов, также вызывает вакуолизацию в мозге крыс. С другой стороны, вакуолей не было отмечено у крыс, принимавших орально NMDA-антагонист декстрометорфан.
На данный момент нет данных, однозначно доказывающих либо опровергающих образование лезий Олни у человека. Не проводилось тестов на образование вакуолей в тканях человеческого мозга под воздействием диссоциативов. Исследования животных, как утверждают критики, не всегда дают результаты, распространяющиеся на человека. Сам Джон Олни заявил в январе 2002 года, что:
Суть в том, что кетамин и многие другие NMDA-антагонисты тестировались на людях, и при этом вызывали острые нарушения работы нейросетей, ведущие к психотическим проявлениям. Те же препараты вызывают аналогичные нарушения у крыс, а при анализе мозга животных мы обнаруживаем свидетельства физического повреждения нейронов. Поскольку никто ещё не анализировал ткани мозга людей непосредственно после приёма данных препаратов, мы не знаем, происходит ли физическое повреждение нейронов у них[2].
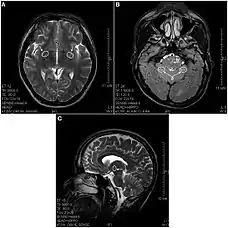
(A) T2-изображение отдела мозга, показывающее дегенеративные гиперинтенсивные пятна в базальном переднем мозге (показано стрелками). (B) T2-изображение, показывающее гиперинтенсивную дегенерацию в мозжечке (a) и в варолиевом мосту (b). (C) Сагиттальное T2-изображение, показывающее дегенеративные пятна в промежуточном мозге (таламус).
В 2013 году вышла статья в которой впервые были использованы МРТ снимки при описании повреждений мозга у принимавших кетамин людей[3]. В выборке участвовали 21 человек со стажем употребления кетамина от 0,5 до 12 лет в дозах от 0,2 до 3 грамм ежедневно. Обнаружены многочисленные лезии во многих областях мозга появляющиеся после 2—4 лет употребления диссоциатива, а также, атрофия коры во фронтальной, теменной и затылочной областях. Есть указания на то, что в результате воздействия кетамина многие структуры человеческого мозга могут получить хронические повреждения, отличные от повреждений от других психоактивных веществ воздействующих на ЦНС (например, кокаина, героина, метамфетамина)[3].
Споры
Уильям Уайт, исследователь декстрометорфана, пришёл к выводу, что лезии Олни формируются и у людей, однако отказался от этого мнения в 2004 году.
В 2003 году исследователь Клифф Андерсон опубликовал критическую статью, целью которой было продемонстрировать, что эксперименты Олни и Фарбера не дают полных оснований ожидать образования лезий в человеческом мозге. Андерсон цитировал результаты неопубликованных исследований на обезьянах по книге Карла Янсена «Кетамин: мечты и реальность»:
Роланд Ауэр вводил MK801 обезьянам инъекционно, но это не привело к образованию вакуолей…
Начнём с того, что метаболизм крыс протекает почти вдвое быстрее человеческого. По причине такого быстрого базального метаболизма кетамин вызывает избыточное возбуждение в дозировках, недостаточных для активации систем, заглушающих активность мозга.
Фрэнк Шарп также работает в этой области. Я обсудил с Шарпом ситуацию по состоянию на 1998 год. На его взгляд, обратимые токсические изменения у крыс начинались с 40 мг/кг, а на уровне 100 мг/кг достигали плато — состояния, когда отмечалась незначительная гибель клеток, но развития процесса не было. Усиленные попытки вызвать токсические изменения у обезьян потерпели фиаско при дозах до 10 мг/кг (внутримышечно). Результаты этих тестов на обезьянах так и остались неопубликованными.
Я решил посоветоваться с коллегой Олни, Нури Фарбером. Его команда показала, что для достижения обратимых изменений у крыс нужно как минимум два часа блокировать N-P рецепторы, а клеточная смерть отмечается при блокаде, длящейся более 24 часов. <…> Он считал, что методы, используемые в работах с обезьянами, неудовлетворительны, ведь для исследований, возможно, брали слишком молодых животных. Токсические изменения отмечаются только у взрослых крыс. Он был не готов согласиться с тем, что обезьяны остались невредимы до тех пор, пока не будут проведены исследования на более пожилых особях, и пока фармацевтические компании не опубликуют проведенные ими исследования на обезьянах в поддержку собственных заявлений о безобидности блокаторов.
Таким образом, в научных публикациях на данный момент (январь 2000) отсутствуют свидетельства того, что кетамин вызывает токсическое изменение числа клеток у обезьян. Известные же нам неопубликованные данные, полученные Фрэнком Шарпом, показывают, что в дозах до 10 мг/кг повреждений не обнаруживается[4].
У. Уайт сделал вывод о том, что ввиду некоторых фундаментальных биологических различий между человеком и крысой, а также из-за малого количества исследований, посвященных лезиям Олни, в настоящее время нельзя утверждать ни о наличии, ни об отсутствии этих нарушений у человека.
Примечания
- Auer R. Effect of age and sex on N-methyl-D-aspartate antagonist-induced neuronal necrosis in rats // Stroke, 1996, 27 (4), pp. 743—746.
- Cliff Anderson. The Bad News Isn’t In. A Look at the Evidence for Specific Mechanisms of Dissociative-Induced Brain Damage and Cognitive Impairment
- Chunmei Wang, Dong Zheng, Jie Xu, Waiping Lam, D. T. Yew. Brain damages in ketamine addicts as revealed by magnetic resonance imaging // Frontiers in Neuroanatomy. — 2013-01-01. — Т. 7. — С. 23. — doi:10.3389/fnana.2013.00023.
- K. Jansen. Ketamine: Dreams and Realities. — MAPS, 2004. — ISBN 0-9660019-7-4.