Рецептор ГАМКA
ГАМКА-рецептор — лиганд-зависимый ионный канал в химических синапсах нервной системы, который тормозит передачу нервного возбуждения и управляется с помощью ГАМК (основного нейротрансмиттера мозга). Это, наряду с ГАМКС-рецептором, один из двух ионотропных ГАМК-рецепторов, отвечающий за реакцию организма на гамма-аминомасляную кислоту. Помимо места, связывающего ГАМК, рецепторный комплекс содержит аллостерические сегменты, способные связывать бензодиазепины, барбитураты, этанол, фуросемид, нейростероиды и пикротоксин.
| Рецептор ГАМКA | |
|---|---|
 | |
| Обозначения | |
| PDB | 4COF |
Морфология

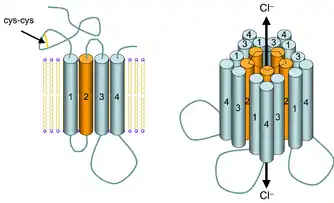
Слева — топология субъединицы. Большой внеклеточный N-концевой домен несёт характеристический цистеиновый мостик (Cys-Cys), который присутствует во всех пентамерных ионных каналах, и места связывания агонистов и модуляторов. Трансмембранные домены показаны в виде цилиндров (1-4) с доменом ТМ2, выстилающим ионный канал (оранжевый). Крупнейшая внутриклеточная петля (между доменами ТМ3 и ТМ4) несёт места связывания многочисленных внутриклеточных модуляторов и сегменты, участвующие в стабилизации и фиксации рецептора в клеточной мембране. В процентах показаны относительные пропорции молекулы субъединицы рецептора, которые находятся по разные стороны плазматической мембраны и внутри неё.
Справа — четвертичная структура рецептора. Пентамерный комплекс субъединиц формирует нативный ГАМКА-рецептор, при этом домены ТМ2 каждой субъединицы расположены так, что формируют ионный канал, по которому проходят анионы Cl- и НСО3- после активации рецептора агонистом (ГАМК).
Ионотропные ГАМКА-рецепторы впервые были выделены из бычьего мозга в 1987 году, и их структура тогда была определена как состоящая из двух субъединиц. Но позже, благодаря методикам молекулярного клонирования было выделено большое количество разных субъединиц, которые могут входить в состав этого рецептора. Перечень субъединиц включает семь различных семей, многие из которых насчитывают более чем один вид белка. Это семьи, α (6 изоформ), β (три изоформы), γ (три изоформы), а также δ, ε, π и θ (одна изоформа в каждой). Гомология (сходство) в последовательностях аминокислот между изоформами одной семьи достигает по меньшей мере 70 %, в то время как между представителями разных семей — меньше чем 40 %; подробнее о свойствах рецепторов, которые образуются различными комбинациями субъединиц, см. в таблице 1.
Каждый функционирующий ГАМКА-рецептор представляет собой гетеропентамер, где все пять субъединиц имеют одинаковую третичную структуру. Эта структура состоит в наличии большого N-терминального домена, характеристическим признаком которого для этого типа рецепторов является дисульфидный мостик между двумя остатками цистеина (так называемая «cys-cys-петля») — черта, присущая всем ионно-канальным рецепторам. Также на N-терминальном домене находятся многочисленные места связывания различных лигандов и участок, который активирует рецептор при связывании с ним молекул ГАМК.
За N-терминальным доменом идут четыре трансмембранных домена (ТМ1-4), среди которых ТМ2 вводит внутреннюю выстилку просвета ионного канала. Между доменами ТМ3 и ТМ4 находится большой внутриклеточный регион, который содержит сегменты, применяемые для фосфорилирования с помощью протеин-киназ, а также места присоединения многочисленных фиксирующих и проводящих протеинов. За доменом ТМ4 расположен очень короткий С-терминал. В целом, количество аминокислотных остатков, которые составляют третичную структуру одной субъединицы, равно примерно 400.
Большое количество типов субъединиц ГАМКА-рецептора (всего 16) приводит к большому количеству структурно отличных ГАМКА-рецепторов, которые могут быть теоретически ими сформированы. Но практически in vivo уровень многообразия функциональных ГАМКА-рецепторов является намного меньшим. Благодаря комплексным молекулярно-биологическим исследованиям было установлено, какие именно комбинации субъединиц могут формировать функциональные ГАМКА-рецепторы — см. Таблицу 1. При этом надо заметить, что не все искусственно синтезированные нормально функционирующие формы рецепторов, приведенные в таблице, в настоящее время найдены в мозге.
Функциональные свойства
Исследования рекомбинантных ГАМКА-рецепторов показали, что функциональные свойства ГАМКА-рецепторов во многом определяются составом субъединиц рецептора. В целом, доказанными могут считаться следующие закономерности:
- Отсутствие β-субъединицы в составе рецептора заметно уменьшает или даже полностью блокирует чувствительность к ГАМК;
- Создание комбинаций α-β увеличивает чувствительность к ГАМК, но полученные таким образом каналы имеют относительно низкую проводимость (12-18 pS). Также эти рецепторы нечувствительны к бенздиазепинам и могут быть ингибированы с помощью низких концентраций Zn2+ (~100-200 нМ);
- Привлечение γ-субъединицы, что приводит к формированию комбинаций α-β-γ, незначительно снижает чувствительность ГАМК сравнению с α-β-рецепторами; также таким рецепторам присуща аллостерическая модуляция бенздиазепинами и заметно меньшая чувствительность к ионам Zn2+ (Около 200—500 μМ). Проводимость ионного канала у рецепторов с таким составом субъединиц примерно на 30 % выше (28-31 pS), чем у форм α-β. Наличие субъединицы γ2, кроме того, стимулирует формирование кластеров (тесных групп) рецепторов на постсинаптической мембране химических синапсов.
Место связывания ГАМК
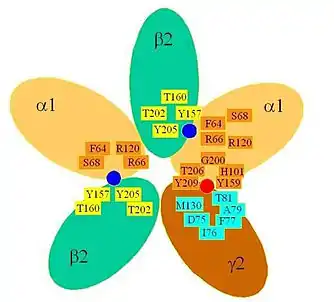
В настоящее время считается, что в состав сегмента связывания ГАМК на ГАМКА-рецепторе входят аминокислотные остатки как от α-, так и β-субъединицы. При этом в составе β-субъединицы для формирования участка связывания ГАМК критическими являются два домена, содержащие аминокислоты YGYT (однобуквенный код, см. статью «аминокислота») — остатки 157—160 субъединицы β2 (здесь и далее буква обозначает однобуквенный код аминокислоты, цифра — номер остатка в цепи молекулы, начиная с N-конца); и, также, YGSY — остатки 202—205. Однако, согласно некоторым теориям, последний домен может быть ассоциирован с механизмом конформационной передачи в процессе открытия ионного канала, а не собственно с участком связывания ГАМК. Перечисленные выше остатки взаимодействуют с остатками F64, R66, S68, R120 субъединицы α1 — таким образом, сегмент связывания ГАМК сформирован на поверхности контакта α- и α-субъединиц.
Аллостерическая модуляция: бензодиазепиновый участок
Исследования рекомбинантных рецепторов показали, что одновременное наличие α- и γ-субъединиц является необходимым для возможности аллостерического регулирования ГАМКА-рецептора с помощью бензодиазепинов. При этом были идентифицированы несколько критически важных аминокислотных остатков — Н101 у α1-субъединицы и F77 γ2-субъединицы — которые влияют на активность связывания.
Кроме того, важную роль играет остаток Т142 у субъединицы γ2, который влияет на эффективность бензодиазепинов. Интересно, что остаток F77 у субъединицы γ2 гомологичен F64 субъединицы α1, что имеет активное влияние на эффект ГАМК. Таким образом, сегмент связывания бензодиазепинов, локализованный на поверхности между субъединицами α и γ, возможно, эволюционно возник из участка связывания агониста (то есть ГАМК).
Набор субъединиц, который формирует нативный рецептор, особенно что касается различных изоформ γ и α субъединиц, может оказывать влияние и на фармакологию бенздиазепинов. Лиганды бенздиазепинового ряда могут действовать как частичные или полные агонисты, потенцирующие действие ГАМК; как антагонисты, которые не имеют никакого влияния на действие ГАМК, но предотвращают действие агонистов-бензодиазепинов; и как частичные или полные обратные агонисты, которые ингибируют активацию рецептора с помощью ГАМК, действуя на бенздиазепиновый участок. Эффекты обратных агонистов могут быть ингибированы антагонистами бензодиазепинового ряда. Рецепторы, которые включают α1- и βіγ2 субъединицы (где i=1-3), имеют высокое родство к бензодиазепинам, диазепаму, CL218872, и золпидему (часто называются рецепторами или лигандами первого типа). CL218872 и золпидем имеют гораздо более низкое сродство с рецепторами, содержащими α2-α3 и α5βіγ2 субъединицы (рецепторы второго типа). Следующая группа рецепторов, α4- и α6βіγ2 — рецепторы, является диазепам-нечувствительной, но способной связывать частичный обратный агонист, Ro-15-4513. В субъединицах α4 и α6 отсутствует критически важный для α1 аминокислотный остаток Н101, который заменен на агринин. Такие диазепам-чувствительные рецепторы называются рецепторами третьего типа.
β-субъединицы и ионный канал
β-субъединицы рецептора сначала считались фармакологически пассивными; тем не менее, недавние исследования показали, что их наличие в составе нативного рецептора является критически необходимым условием для его функционирования, а различные конформации β-субъединиц могут влиять на эффект лигандов, которые с этими субъединицами непосредственно не связаны (например, на эффекты лореклезола). Во всех известных на настоящее время случаях воздействия на эффекты лигандов ГАМКA-рецептора со стороны его β-субъединиц разница в рецепторном ответе обусловлена мутациями (то есть заменами) одного и того же аминокислотного остатка — на позиции 290 в сегменте ТМ2. В случае β1-субъединицы это место занимает серин, и эффект лореклезола при этом не меняется или ингибируется; в случае β2-субъединицы на этом месте находится аспарагин, который заметно потенцирует (увеличивает) эффект лореклезола и ряда других соединений.
Другой остаток, который сильно влияет на чувствительность αβ-вмещающих ГАМКA-рецепторов — это Н267, который находится на внешней части домена ТМ2. Этот остаток гистидина формирует часть сегмента связывания Zn2+, делая рецептор чувствительным к ингибированию ионами цинка в концентрации около 100 нМ. Локализация этого аминокислотного остатка внутри хлорного канала рецептора и тот факт, что двувалентный катион цинка может проникать в канал, приспособленный для прохождения одновалентных анионов, независимо от того, активирован рецептор или нет, являются признаками локализации ион-селектирующей части рецепторной молекулы и механизма открытия канала на противоположном конце рецептора.
Таблицы
- Таблица 1. Формы ГАМКA-рецепторов, найденные в нервной системе
| Комбинация субъединиц | Распространение и свойства |
| α1βγ2 | Самая обыкновенная изоформа, ~40% всех ГАМКА-рецепторов; широко распространена в химических синапсах нервной системы. |
| α2βγ2 | Довольно обычная, также широко распространена. |
| α3βγ2 | Не такая обычная, как две предыдущие, широко распространена. |
| α4βγ2/δ | Относительно редкая, найдена в гиппокампе и таламусе. Возможно, является внесинаптическим рецептором. |
| α5βγ2 | Относительно редкая, найдена в гиппокампе. |
| α6βγ2/δ | Найдена лишь в гранулярном слое мозжечка и в нервных клетках улитке уха. Возможно, является внесинаптическим рецептором. |
| α1α2-6βγ2 | Рецепторы, которые содержат две разные формы α-субъединицы, вероятно, являются очень редкими, если вообще такая комбинация способна формировать функциональный рецептор. Об их существовании можно утверждать, основываясь на результатах иммунных реакций с использованием селективных сывороток. |
| α2α3-6βγ2 | Относительно редкая, если вообще способна формировать функциональные рецепторы. |
| α3α4-6βγ2 | Относительно редкая, если вообще способна формировать функциональные рецепторы. |
- Таблица 2. Свойства ГАМКA-рецепторов
| Природный агонист | ГАМК |
| Селективный агонист | Изогувацин |
| Антагонист | Пикротоксин |
| Селективный антагонист | Бикукуллин |
| Модуляторы: бенздиазепины | Потенцирование |
| Барбитураты | Потенцирование |
| Zn2+ (IC50) | Ингибирование (αβ — 100-500nM; αβγ — 100-500mM) |
| Нейростероиды | Потенцирование/ингибирование |
| Эффективность ГАМК (ЕС50) | 2-30μM |
| Ионы, проходящие через канал | Cl- та НСО3- |
| Активация рецептора | Быстрая (миллисекунды) |
| Десенситизация | Быстрая и глубокая |
| Проводимость канала | 25-32pS |
Субъединицы ГАМК-А рецептора человека
Существуют следующие субъединицы[1]:
- Шесть α субъединиц (GABRA1, GABRA2, GABRA3, GABRA4, GABRA5, GABRA6)
- Три β субъединицы (GABRB1, GABRB2, GABRB3)
- Три γ субъединицы (GABRG1, GABRG2, GABRG3)
- δ-субъединица (GABRD), ε-субъединица (GABRE), π-субъединица (GABRP), θ-субъединица (GABRQ)
Примечания
- Martin IL and Dunn SMJ. GABA receptors A review of GABA and the receptors to which it binds. Tocris Cookson LTD.
Литература
- Bormann J (2000): The «ABC» of GABA receptors. Trends Pharmacol Sci 21:16-19.
- Feigenspan A, Wassle H, Bormann J (1993): Pharmacology of GABA receptor Cl- channels in rat retinal bipolar cells. Nature 361:159-162.
- Fritschy J-M, Mohler H (1995): GABAA receptor heterogeneity in the adult rat brain: differential regional and cellular distribution of seven major subunits. J Comp Neurol 359:154-194.
- Hosie AM, Aronstein K, Sattelle DB, Ffrench-Constant RH (1997): Molecular biology of insect neuronal GABA receptors. Trends Neurosci. 20:578-583.
- Jones A, Korpi ER, McKernan RM, Pelz R, et al. (1997): Ligand-gated ion channel subunit partnerships: GABAA receptor 6 subunit gene inactivation inhibits delta subunit expression. J Neurosci 17:1350-1362.
- Korpi ER, Grunder G, Luddens H (2002): Drug interactions at GABAA receptors. Prog Neurobiol 67:113-159.
- Moss SJ, Smart TG (1996): Modulation of amino acid-gated ion channels by protein phosphorylation. Int Rev Neurobiol 39:1-52.
- Rabow LE, Russek SJ, Farb DH (1996): From ion currents to genomic analysis: Recent advances in GABAA receptor research. Synapse 21:189-274.
- Rudolph U, Crestani F, Benke D, Brunig I, et al. (1999): Benzodiazepine actions mediated by specific γ-aminobutyric acid (A) receptor subtypes. Nature 401:796-800.
- Smith GB, Olsen RW (1995): Functional domains of GABAA receptors. Trends Pharmacol Sci 16:162-168.
- Whiting PJ, McKernan RM, Wafford KA (1995): Structure and pharmacology of vertebrate GABAA receptor subtypes. Int Rev Neurobiol 38:95-138.