Лигирование по Штаудингеру
Лигирование по Штаудингеру (англ. Staudinger ligation) — модификация реакции Штаудингера, широко применяемая в области химической биологии и биоконъюгации для ковалентного связывания биомолекул с низкомолекулярными метками, а также для мечения клеток в живых организмах. Реакция предложена в 2000 году группой К. Бертоцци[1]. Поскольку участвующие в ней функциональные группы (азид и фосфин) практически не представлены в организмах и не склонны взаимодействовать с природными соединениями, лигирование по Штаудингеру относится к биоортогональным реакциям.
Биоортогональность
Лигирование по Штаудингеру стало первым примером биоортогональной реакции, способной протекать в клетках живых организмов, не мешая естественным биохимическим процессам. Его открытие произошло в результате поиска химических реакций, протекающих между функциональными группами, которые редко встречаются в биомолекулах и, как следствие, имеют совершенно отличную реакционную способность, нежели наиболее часто встречающиеся природные функциональные группы.
Согласно теории жёстких и мягких кислот и оснований, азид и фосфин относятся к мягким электрофилам и нуклеофилам соответственно, в то время как биомолекулы содержат, в основном, жёсткие нуклеофилы, которые к реакциям с азидами неспособны.
На примере лекарственных препаратов (азидотимидин) было показано, что азиды являются биосовместимыми, а фосфины практически не встречаются в биомолекулах[2] и не восстанавливают дисульфидные связи.
Механизм
Реакция основана на взаимодействии азида, являющегося мягким электрофилом, и фосфина — мягкого нуклеофила. На первой стадии происходит нуклеофильное присоединение фосфина к терминальному атому азота азидной группы, в результате чего образуется фосфазид 1. Далее через промежуточное образование четырёхчленного цикла 2 фосфазид отщепляет молекулу азота и образует иминофосфоран 3. В классической реакции Штаудингера данная стадия являлась завершающей, после чего иминофосфоран обычно подвергали гидролизу с образованием двух продуктов - амина и оксида фосфина. Модификация, предложенная К. Бертоцци, состоит во введении в один из арильных заместителей фосфина сложноэфирной группы в качестве электрофильной ловушки. В таком случае нуклеофильный атом азота иминофосфорана атакует сложноэфирную группу с образованием бициклического продукта 4. Гидролиз связи P—N даёт один конечный продукт 5, в котором биомолекула и метка связаны посредством прочной амидной связи[3].
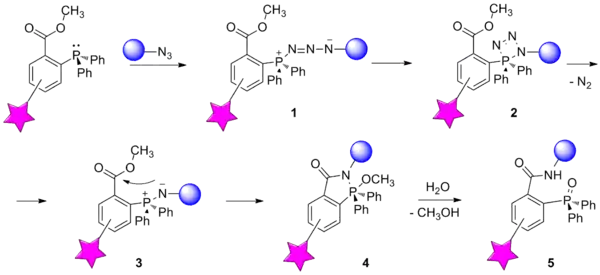
Бесследовое лигирование по Штаудингеру
Вскоре после появления публикации К. Бертоцци было предложено несколько вариантов лигирования по Штаудингеру, в которых образующийся в реакции оксид фосфина удаляется из конечного продукта путём гидролиза. Такая модификация получила название бесследового (англ. traceless) лигирования по Штаудингеру. С точки зрения химии, удаление оксида фосфина было реализовано путём модификации реагентов таким образом, чтобы фосфин в итоге оказывался в спиртовой части сложного эфира и отщеплялся при атаке нуклеофильного атома азота иминофосфоранового интермедиата.
Группа Р. Т. Рейнса встроила вспомогательный меркаптановый фрагмент в фосфин для переэтерификации тиоэфира защищённой аминокислоты. При введении в реакцию азида образуется иминофосфоран, в результате перегруппировки в котором фосфин отщепляется и далее гидролизуется водой. Данный подход был применён для синтеза пептида и может стать альтернативой нативному химическому лигированию[4].
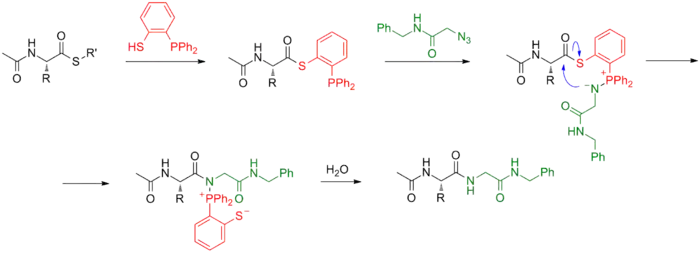
Саксон и Бертоцци также предложили свои фосфиновые реагенты для бесследового лигирования по Штаудингеру, продемонстрировав возможности реакции на примере азидсодержащего нуклеозида[5].
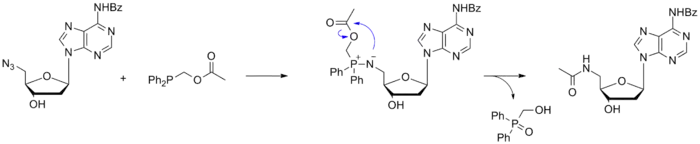
Подобный подход был использован для синтеза гликопротеинов. При этом фосфин вводился в сложноэфирную группу модифицированного углевода, который далее реагировал с азид-содержащим белком с образованием продукта, в котором углевод и белок были связаны прочной амидной связью[6].

Применение
Реакция применялась для модификации азид-содержащих биомолекул различными низкомолекулярными метками (биотином, флуоресцентными красителями, пептидом FLAG), а также для конъюгирования пептидов, белков, модификации поверхностей и др.[7]
См. также
Примечания
- Saxon E., Bertozzi C. R. Cell Surface Engineering by a Modified Staudinger Reaction (англ.) // Science. — 2000. — Vol. 287, no. 5460. — P. 2007–2010. — doi:10.1126/science.287.5460.2007. — PMID 10720325.
- Chakraborty A., Wang D., Ebright Y. W., Ebright R. H. Azide-Specific Labelling of Biomolecules by Staudinger-Bertozzi Ligation: Phosphine Derivatives of Fluorescent Probes Suitable for Single-Molecule Fluorescence Spectroscopy (англ.) // Methods Enzymol. — 2010. — Vol. 472. — P. 19–30. — doi:10.1016/S0076-6879(10)72018-8.
- Lin F. L., Hoyt H. M., van Halbeek H., Bergman R. G., Bertozzi C. R. Mechanistic Investigation of the Staudinger Ligation (англ.) // J. Am. Chem. Soc. — 2005. — Vol. 127, no. 8. — P. 2686–2695. — doi:10.1021/ja044461m. — PMID 15725026.
- Nilsson B. L., Kiessling L. L., Raines R. T. Staudinger Ligation: A Peptide from a Thioester and Azide (англ.) // Org, Lett. — 2000. — Vol. 2, no. 13. — P. 1939–1941. — doi:10.1021/ol0060174.
- Saxon E., Armstrong J. I., Bertozzi C. R. A “Traceless” Staudinger Ligation for the Chemoselective Synthesis of Amide Bonds (англ.) // Org, Lett. — 2000. — Vol. 2, no. 14. — P. 2141-2143. — doi:10.1021/ol006054v.
- Bernardes G. J. L., Linderoth L., Doores K. J., Boutureira O., Davis B. G. Site-Selective Traceless Staudinger Ligation for Glycoprotein Synthesis Reveals Scope and Limitations (англ.) // ChemBioChem. — 2011. — Vol. 12, no. 9. — P. 1383–1386. — doi:10.1002/cbic.201100125.
- van Berkel S. S., van Eldijk M. B., van Hest J. C. M. Staudinger Ligation as a Method for Bioconjugation // Angew. Chem. Int. Ed. — 2011. — Т. 50, № 38. — С. 8806–8827. — doi:10.1002/anie.201008102.
Литература
- van Berkel S. S., van Eldijk M. B., van Hest J. C. M. Staudinger Ligation as a Method for Bioconjugation // Angew. Chem. Int. Ed. — 2011. — Т. 50, № 38. — С. 8806–8827. — doi:10.1002/anie.201008102.
- Schilling C. I., Jung N., Biskup M., Schepers U., Bräse S. Bioconjugation via azide–Staudinger ligation: an overview // Chem. Soc. Rev. — 2011. — Т. 40, № 9. — С. 4840-4871. — doi:10.1039/C0CS00123F.