Койевая кислота
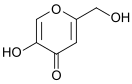
Койевая кислота (от яп. 麹 /kōji/ — койи) — органическое соединение, представляет собой гидроксильное производное γ-пирона (кетопроизводное пирана).[2]
| Койевая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
5-Гидрокси-2-(гидроксиметил)-4H-пиран-4-он | ||
| Традиционные названия | 5-Гидрокси-2-(гидроксиметил)-4-пирон, 2-Гидроксиметил-5-гидрокси-γ-пирон | ||
| Хим. формула | C6H6O4 | ||
| Физические свойства | |||
| Молярная масса | 142,11 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | от 152 до 155 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9.40[1] | ||
| Растворимость | |||
| • в вода, этанол, этилацетат | легко растворима | ||
| • в диэтиловый эфир, хлороформ | трудно растворима | ||
| • в бензол | не растворима | ||
| Классификация | |||
| Рег. номер CAS | 501-30-4 | ||
| PubChem | 3840 | ||
| Рег. номер EINECS | 207-922-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | UQ0875000 | ||
| ChEBI | 43572 | ||
| Номер ООН | 6K23F1TT52 | ||
| ChemSpider | 3708 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Этимология
Название кислоты имеет японское происхождение. Койевая кислота впервые была выделена в 1907 году японским профессором Кендо Сайто из продуктов ферментации вареного риса специальными плесневыми грибками (яп. カビ麹 - плесень койи или кодзи) используемыми для производстве сакэ.[3]
Физические свойства
Бесцветные кристаллы практически без запаха. Обладает достаточно высокой растворимостью в воде, низших спиртах (метанол, этанол, пропанол) и сложных эфирах. Мало растворима в простых эфирах (диэтиловый эфир), галогенуглеводородах (хлороформ) и т.п. Не растворима в бензоле и толуоле.[2]
Химические свойства
Койевая кислота в водных растворах ведет себя как одноосновная кислотой очень малой силы (pKa=9.40), что ставит её в один ряд с фенолом.
Образует комплексные соединения металлами. Конденсируется с ароматическими соединениями и основаниями Шиффа, аминометилируется по Манниху. При сочетании с солями диазония замещение идет в положение 6.[2]
С переходными металлами образует комплексы. При нагревании с хлорангидридом серной кислоты SO2Cl2 в среде хлороформа СНСl3 дает 5-гидрокси-2-хлорметил-γ-пирон.[2] Дает интенсивное вишнево-красное окрашивание с раствором хлорида железа (III) FеСl3.
Биологическая роль
В природе образуется в результате жизнедеятельности плесневых грибов из родов Aspergillus и Penicillium, а также палочковидных бактерий рода Enterobacter и др.
В свободном состоянии образуется при выращивании так называемого японского гриба в растворах тростникового сахара, глюкозы и т.п.[4]
Получение
В промышленности койевая кислота вырабатывается путем сбраживания различных углеводов имеющих пирановое кольцо в циклической форме (глюкозы, сахарозы, арабинозы, ксилозы и др.[5]) с помощью штаммов Aspergillus orizae, Aspergillus glaucus и др.[6]
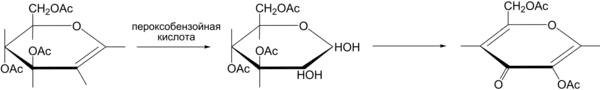
В лаборатории может быть получена гидролизом сложных эфиров койевой кислоты получаемых из сложных эфиров 1,2-глюкозеенов. Вначале путем гидроксилирования гликозеенов под действием пероксобензойной кислоты получают гидратированной формы озонов, которые затем при обработке основаниями претерпевают сложные превращение и образуют требуемые эфиры койевои кислоты[4]:
Применение
В аналитической химии койевая кислота иногда используется как реагент для определения ионов тяжелых металлов: Fe2+ , Fe3+, Сu2+, Рb2+, Zn2+, Co2+, Mo2+, V3+.[2]
Койевую кислоту можно использовать при переработке свежих фруктов и морепродуктов для предотвращения их потемнения исохранения яркой окраски. Диэфиры койевой кислоты входят в состав кремов и лосьонов, осветляющих кожу и защищающих ее от действия света.[2] Используется также для лечения некоторых кожных заболеваний, таких как меланодермия.[7]
Койевая кислота обладает выраженным бактерицидным, инсектицидным и противогрибковыми действием[2], а также определенной цитотоксической активностью по отношению к человеческим цервикальным раковым клеткам (HeLa) и человеку рак толстой кишки клетке (Сасо).[8]
Примечания
- Bjerrum, J., et al. Stability Constants, Chemical Society, London, 1958.
- Хвостов И. В. Койевая кислота // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М. : Советская энциклопедия, 1990. — Т. 2 : Даф-Мед. — 671 с. — ISBN 5-82270-035-5.
- Леенсон, Илья Абрамович. Язык химии. Этимология химических названий. — М.: Corpus, 2016. — 464 с. — ISBN 978-5-17-095739-2.
- Чичибабин А. Е. сновные начала органической химии. — 6 изд.. — М.: Наука, 1958. — Т. 2. — 974 с.
- Кочетков Н.К., Бочков А. Ф., Дмитриев Б. А. Химия углеводов. — М.: Наука, 1967. — 672 с.
- Мальцев П.М. Технология бродильных производств. — 2-е изд., перераб. и доп.. — М.: Пищевая промышленность, 1980. — 560 с.
- Melasma (англ.). www.aad.org. American Academy of Dermatology (2009). Дата обращения: 23 декабря 2009. Архивировано 23 декабря 2009 года.
- Veverka, M. Cocrystals of quercetin: synthesis, characterization, and screening of biological activity / Dubaj, T., Gallovič, J., Jorík, V., Veverková, E., Danihelová, M., Šimon, P. // Monatshefte für Chemie-Chemical Monthly. — 2015. — № 146(1). — С. 99-109. — doi:10.1007/s00706-014-1314-6.