Карнитин-пальмитоилтрансфераза I
Карнитин-пальмитоилтрансфераза I, также карнитинацилтрансфераза I, карнитинацил-СоА-трансфераза I или пальмитоил-CoA-трансфераза I (англ. Carnitine palmitoyltransferase I, сокр. CPT1) — митохондриальный фермент, одна из форм карнитин-О-пальмитоилтрансферазы (КФ 2.3.1.21), относится к семейству ацилтрансфераз[1]. Катализирует перенос ацильной группы (—COR) от молекулы ацил-CoA жирных кислот с длинной углеводородной цепью на молекулу карнитина, с образованием ацилкарнитина и свободной молекулы кофермента А. Часто продуктом реакции является пальмитоилкарнитин (откуда и название фермента), однако, в качестве субстрата могут выступать и другие остатки жирных кислот (ацильные группы —COR)[2][3]. Один из нескольких ферментов карнитиновой транспортной системы. Ген, кодирующий данный фермент локализуется в 11-ой хромосоме — CPT1A.
Существует 3 изоформы фермента: CPT1A, CPT1B и CPT1C. CPT1 связан с внешней митохондриальной мембраной. Активность данного фермента может быть снижена с помощью малонил-CoA (является ингибитором), промежуточный метаболит, участвующий в биосинтезе жирных кислот. Карнитин-пальмитоилтрансфераза I играет важную роль в различных метаболических нарушениях, таких как, например, диабет. Однако до сих пор неизвестна кристаллическая структура, вследствие чего его точный механизм действия остаётся неизвестным.
Структура
СPT1 относится к интегральным мембранным белкам, который связан с внешней митохондриальной мембраной, посредством трансмембранных областей в пептидной цепи. Оба концевые N- и C- домены располагаются на цитоплазматической стороне мембраны[4].
Все три изоформы фермента встречаются в тканях млекопитающих. Печёночная изоформа (CPT1A или CPTI-L) локализуется в митохондриях всех клеток организма, за исключением клеток скелетных мышц и клеток бурой жировой ткани[5][6]. Мышечная изоформа (CPT1B или CPTI-M) высокоэкспрессивный белок, образующийся в миокарде сердца, в клетках скелетной мускулатуры (миоцитах) и клетках бурой жировой ткани[4][5][6]. Третья изоформа — мозговая (CPT1C), была выделена в 2002 году и располагается преимущественно в головном мозге и яичках. Об этой форме мало что известно[7][8].
Точная структура всех изоформ CPT1 до сих пор не определена, хотя на основе близкородственных CPT1 ферментов — ацилкарнитинтрансфераз, таких, как карнитин-ацетилтрансфераза (CRAT) были созданы модели in silico[9].
Важным структурным различием между CPT1 и CPT2, CRAT и карнитин-октаноилтрансферазой (COT) является то, что CPT1 содержит дополнительный домен на N-конце, состоящий примерно из 160 аминокислот. Было установлено, что этот дополнительный N-концевой домен имеет важное значение для молекулы ключевого ингибитора фермента — малонил-CoA[10].
Было предложено два различных участка связывания, существующих в CPT1A и CPT1B. Участок А или участок СoA по-видимому, связывают как малонил-CоА и пальмитоил-CоА, так же и другие молекулы, содержащие кофермент А. Предполагают, что фермент связывает эти молекулы посредством взаимодействия с фрагментом кофермента. Было высказано предположение, что малонил-CоА может вести себя как конкурентный ингибитор CPT1A на этом участке. На втором — участке О полагают, что малонил-CоА связывается намного плотнее, чем на участке А. В отличие от участка A, участок O связывается с малонил-CоА через дикарбонильную группу малоната[11] . Связывание малонил-СоА к ферменту участками А и О, ингибирует действие CPT1A путём исключения связывания карнитина ферментом.
Механизм реакции
Ввиду того, что данные о кристаллической структуре фермента отсутствуют, точный механизм катализа CPT1 до сих пор неизвестен. Пара различных возможных механизмов CPT1 постулировались, оба из которых включают в себя остаток гистидина — His473, служащего в качестве ключевого каталитического центра. Один из таких механизмов основан на модели карнитин-ацетилтрансферазы показан ниже, в котором остаток His473 депротонирует карнитин, в то время как располагающийся рядом остаток серина стабилизирует тетраэдрический интермедиат оксианиона.
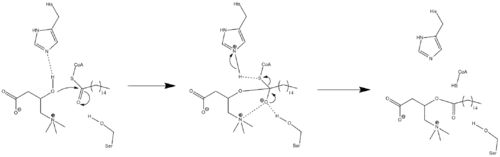
Другой механизм основывается, на предположении о том, существует так называемая каталитическая триада, состоящая из остатков аминокислот Cys-305, His-473, и Asp-454, которые осуществляют каталитический перенос ацила[12]. Этот каталитический механизм включает формирование ковалентного тиоацил-фермент интермедиата с Cys-305.
Биологические функции
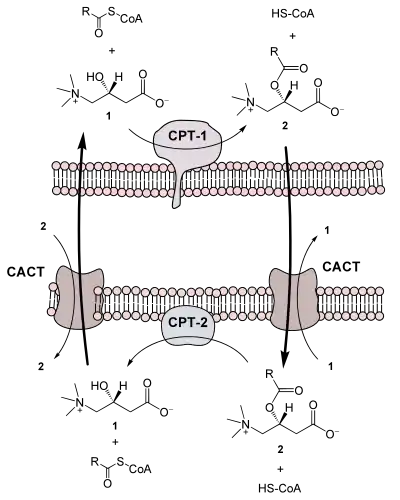
Карнитин-пальмитоилтрансферазная система является важной ступенью в бета-окислении длинноцепочечных жирных кислот. Длинноцепочечные жирные кислоты, такие как пальмитоил-СоА, в отличие от коротко- и среднецепочечные жирные кислоты не могут свободно диффундировать через внутреннюю мембрану митохондрий (она непроницаемая), для этого перехода существует карнитиновый челнок, транспортирующий их в матрикс[13].
Карнитин-пальмитоилтрансфераза I — первый компонент системы и лимитирующий скорость химической реакции карнитиновой транспортной системы, катализирующий перенос ацильной группы от кофермента А на карнитин с образованием пальмитоилкарнитина. С помощью транслоказы (карнитин-ацилкарнитинтранслоказа, СACT) пальмитоилкарнитин посредством облегчённой диффузии (антипорт) переносится через внутреннюю мембрану митохондрии в матрикс.
Действуя в качестве акцептора ацильной группы, карнитин может также играть роль в регуляции внутриклеточного пула кофермента А: соотношение ацил-CoA/CoА[14].
Регуляция
CPT1 ингибируется малонил-СоА, хотя точный механизм ингибирования остаётся неизвестным. Изоформа CPT1 скелетных мышц и миокарда (CPT1B), как было показано, может быть в 30-100 раз более чувствительным к ингибированию малонил-CoA, чем аналогичная изоформа CPT1A. Данное ингибирование является хорошей целью для будущих попыток регулировать CPT1 в терапии метаболических нарушений[15].
Ацетил-СоА-карбоксилаза (АСС) — фермент, который катализирует образование малонил-СоА из ацетил-CоА , играет важную роль в регуляции метаболизма жирных кислот. Учёные продемонстрировали, что ACC2 нокаутных мышей приводят к уменьшение жира и веса по сравнению с диким типом мышей. Это является результатом сниженной активности ACC, которые вызывают последующее снижение концентраций малонил-СоА. Такие сниженные уровни малонил-СоА, в свою очередь предотвращают торможение CPT1, в результате чего происходит предельное увеличение окисления жирных кислот[16]. Так как сердце и клетки скелетных мышц имеют низкую способность к синтезу жирных кислот, то АСС может выступать исключительно в качестве регулирующего фермента в этих клетках.
Медицинское значение
У человек описан только дефицит "CPT1A" (дефицит карнитин-пальмитоилтрансферазы I)[17] . Это редкое заболевание, характеризующееся высокими рисками развития гипокетонимической гипогликемии, судорог, печёночной энцефалопатии, у новорождённых — внезапная младенческая смерть[18].
CPT1 связан также с сахарным диабетом 2-го типа и инсулиновой резистентностью.
Новые исследования, представленные на съезде в 2015 году Европейского комитета по лечению и исследованию рассеянного склероза (ECTRIMS) свидетельствует о том, что CPT1 также может играть роль в патологии рассеянного склероза (РС)[19]. Исследователи обнаружили, что мутации в гене CPT1 появляются для защиты от рассеянного склероза в определённых популяциях. Данная гипотеза состоит в том, что увеличение метаболизма липидов может привести к димиелинизации нервных клеток (разрушению миелина), тем самым позволяя проведению аутоиммунной атаки на нервные клетки. Доктор философии Джон Дирк Ниланд и его коллеги из Университета Ольборг в Дании предоставили данные, показывающие, что в животных моделях, больных РС, CPT1 блокируется молекулой, называемой этомоксир, скорее всего для смягчения симптомов этого заболевания[20] . В настоящее время исследователи ищут поддержки для клинического исследование у больных людей.
Взаимодействия с другими белками
Известно что CPT1 взаимодействует со множеством белков, в том числе из семейства NDUF, PKC1 и ENO1[21].
Нокаутированный CPT1A с помощью скрининга shRNA библиотеки ингибирует репликацию ВИЧ-1 в культуре Jurkat Т-клеток[22].
Примечания
- Jogl G., Tong L. Crystal structure of carnitine acetyltransferase and implications for the catalytic mechanism and fatty acid transport (англ.) // Cell : journal. — Cell Press, 2003. — January (vol. 112, no. 1). — P. 113—122. — doi:10.1016/S0092-8674(02)01228-X. — PMID 12526798.
- van der Leij F.R., Huijkman N.C., Boomsma C., Kuipers J.R., Bartelds B. Genomics of the human carnitine acyltransferase genes (англ.) // Molecular Genetics and Metabolism : journal. — 2000. — Vol. 71, no. 1—2. — P. 139—153. — doi:10.1006/mgme.2000.3055. — PMID 11001805.
- Bonnefont J.P., Djouadi F., Prip-Buus C., Gobin S., Munnich A., Bastin J. Carnitine palmitoyltransferases 1 and 2: biochemical, molecular and medical aspects (англ.) // Molecular Aspects of Medicine : journal. — 2004. — Vol. 25, no. 5—6. — P. 495—520. — doi:10.1016/j.mam.2004.06.004. — PMID 15363638.
- Yamazaki N., Yamanaka Y., Hashimoto Y., Shinohara Y., Shima A., Terada H. Structural features of the gene encoding human muscle type carnitine palmitoyltransferase I (англ.) // FEBS Letters : journal. — 1997. — June (vol. 409, no. 3). — P. 401—406. — doi:10.1016/S0014-5793(97)00561-9. — PMID 9224698.
- Brown N.F., Hill J.K., Esser V., Kirkland J.L., Corkey B.E., Foster D.W., McGarry J.D. Mouse white adipocytes and 3T3-L1 cells display an anomalous pattern of carnitine palmitoyltransferase (CPT) I isoform expression during differentiation. Inter-tissue and inter-species expression of CPT I and CPT II enzymes (англ.) // The Biochemical Journal : journal. — 1997. — October (vol. 327 ( Pt 1)). — P. 225—231. — PMID 9355756.
- Lee J., Ellis J.M., Wolfgang M.J. Adipose fatty acid oxidation is required for thermogenesis and potentiates oxidative stress-induced inflammation (англ.) // Cell Reports : journal. — 2015. — January (vol. 10, no. 2). — P. 266—279. — doi:10.1016/j.celrep.2014.12.023. — PMID 25578732.
- Price N., van der Leij F., Jackson V., Corstorphine C., Thomson R., Sorensen A., Zammit V. A novel brain-expressed protein related to carnitine palmitoyltransferase I (англ.) // Genomics : journal. — Academic Press, 2002. — October (vol. 80, no. 4). — P. 433—442. — doi:10.1006/geno.2002.6845. — PMID 12376098.
- Lavrentyev E.N., Matta S.G., Cook G.A. Expression of three carnitine palmitoyltransferase-I isoforms in 10 regions of the rat brain during feeding, fasting, and diabetes (англ.) // Biochemical and Biophysical Research Communications : journal. — 2004. — February (vol. 315, no. 1). — P. 174—178. — doi:10.1016/j.bbrc.2004.01.040. — PMID 15013442.
- Morillas M., López-Viñas E., Valencia A., Serra D., Gómez-Puertas P., Hegardt F.G., Asins G. Structural model of carnitine palmitoyltransferase I based on the carnitine acetyltransferase crystal (англ.) // The Biochemical Journal : journal. — 2004. — May (vol. 379, no. Pt 3). — P. 777—784. — doi:10.1042/BJ20031373. — PMID 14711372.
- Woldegiorgis G., Dai J., Arvidson D. Structure-Function Studies with the Mitochondrial Carnitine Palmitoyltransferases I and II (англ.) // Monatshefte fur Chemie : journal. — 2005. — Vol. 136, no. 8. — P. 1325—1340. — doi:10.1007/s00706-005-0334-7.
- López-Viñas E., Bentebibel A., Gurunathan C., Morillas M., de Arriaga D., Serra D., Asins G., Hegardt F.G., Gómez-Puertas P. Definition by functional and structural analysis of two malonyl-CoA sites in carnitine palmitoyltransferase 1A (англ.) // The Journal of Biological Chemistry : journal. — 2007. — June (vol. 282, no. 25). — P. 18212—18224. — doi:10.1074/jbc.M700885200. — PMID 17452323.
- Liu H., Zheng G., Treber M., Dai J., Woldegiorgis G. Cysteine-scanning mutagenesis of muscle carnitine palmitoyltransferase I reveals a single cysteine residue (Cys-305) is important for catalysis (англ.) // The Journal of Biological Chemistry : journal. — 2005. — February (vol. 280, no. 6). — P. 4524—4531. — doi:10.1074/jbc.M400893200. — PMID 15579906.
- Berg JM, Tymoczo JL, Stryer L, "Biochemistry", 6th edition 2007
- Jogl G., Hsiao Y.S., Tong L. Structure and function of carnitine acyltransferases (англ.) // Annals of the New York Academy of Sciences : journal. — 2004. — November (vol. 1033, no. 1). — P. 17—29. — doi:10.1196/annals.1320.002. — PMID 15591000.
- Shi J., Zhu H., Arvidson D.N., Woldegiorgis G. The first 28 N-terminal amino acid residues of human heart muscle carnitine palmitoyltransferase I are essential for malonyl CoA sensitivity and high-affinity binding (англ.) // Biochemistry : journal. — 2000. — February (vol. 39, no. 4). — P. 712—717. — doi:10.1021/bi9918700. — PMID 10651636.
- Abu-Elheiga L., Oh W., Kordari P., Wakil S.J. Acetyl-CoA carboxylase 2 mutant mice are protected against obesity and diabetes induced by high-fat/high-carbohydrate diets (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2003. — September (vol. 100, no. 18). — P. 10207—10212. — doi:10.1073/pnas.1733877100. — PMID 12920182.
- Ogawa E., Kanazawa M., Yamamoto S., Ohtsuka S., Ogawa A., Ohtake A., Takayanagi M., Kohno Y. Expression analysis of two mutations in carnitine palmitoyltransferase IA deficiency (англ.) // Journal of Human Genetics : journal. — 2002. — Vol. 47, no. 7. — P. 342—347. — doi:10.1007/s100380200047. — PMID 12111367.
- Collins S.A., Sinclair G., McIntosh S., Bamforth F., Thompson R., Sobol I., Osborne G., Corriveau A., Santos M., Hanley B., Greenberg C.R., Vallance H., Arbour L. Carnitine palmitoyltransferase 1A (CPT1A) P479L prevalence in live newborns in Yukon, Northwest Territories, and Nunavut (англ.) // Molecular Genetics and Metabolism : journal. — 2010. — Vol. 101, no. 2—3. — P. 200—204. — doi:10.1016/j.ymgme.2010.07.013. — PMID 20696606.
- Wilner, AN (December 1, 2015), Exploring a New Mechanism of action for MS Drugs, An Expert Interview With John Dirk Nieland, PhD, Medscape, <http://www.medscape.com/viewarticle/854957>. Проверено 3 декабря 2015.
- Nieland JD Nieland JG Mørkholt AS Bolther L Nielsen S (October 7–10, 2015), Abstract P1497. CPT1a mutation leads the way for new medication for the treatment of multiple sclerosis, 31st Congress of the European Committee for the Treatment and Research in Multiple Sclerosis (ECTRIMS), Barcelona, Spain, Final Programme
- Havugimana P.C., Hart G.T., Nepusz T., Yang H., Turinsky A.L., Li Z., Wang P.I., Boutz D.R., Fong V., Phanse S., Babu M., Craig S.A., Hu P., Wan C., Vlasblom J., Dar V.U., Bezginov A., Clark G.W., Wu G.C., Wodak S.J., Tillier E.R., Paccanaro A., Marcotte E.M., Emili A. A census of human soluble protein complexes (англ.) // Cell. — Cell Press, 2012. — August (vol. 150, no. 5). — P. 1068—1081. — doi:10.1016/j.cell.2012.08.011. — PMID 22939629.
- Yeung M.L., Houzet L., Yedavalli V.S., Jeang K.T. A genome-wide short hairpin RNA screening of jurkat T-cells for human proteins contributing to productive HIV-1 replication (англ.) // The Journal of Biological Chemistry : journal. — 2009. — July (vol. 284, no. 29). — P. 19463—19473. — doi:10.1074/jbc.M109.010033. — PMID 19460752.