Карнитин-О-ацетилтрансфераза
Карнитин-О-ацетилтрансфераза, также Карнитин-ацетилтрансфераза, сокр. КАТ (англ. Carnitine O-acetyltransferase, сокр. CRAT)[1] (КФ 2.3.1.7) — фермент из группы ацилтрансфераз, катализирующий перенос ацетильной группы (СH3-CO) от молекулы ацетил-КоА на молекулу субстрата — карнитина и обратно, когда субстратом уже служит кофермент А, по уравнению:
ацетил-КоА + карнитин КоА-SH + О-ацетилкарнитин[2].
Продуктами реакции являются соответственно ацетилкарнитин и кофермент А (КоА-SH).
Ген, кодирующий данный фермент CRAT локализован на 9-ой хромосоме.
Различные субклеточные локализации CRAT мРНК, как полагают, являются результатом альтернативного сплайсинга гена, кодирующего данный фермент. Альтернативный сплайсинг приводит к образованию трёх изоформ, одна из которых содержит N-концевой сигнал транспорта в митохондрии, и согласно наблюдениям локализуется именно там[3].
Номенклатура
Данный фермент принадлежит к семейству ацилтрансфераз, катализирующих перенос ацетильной группы с молекулы ацетил-КоА на молекулу субстрата — карнитина — и обратно. Систематическое название фермента — карнитин-О-ацетилтрансфераза. Другие названия фермента: Ацетил-КоА-карнитинтрансфераза, карнитинацетил-КоА-трансфераза, ацетил-карнитинтрансфераза и др.
Структура
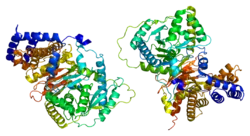
Карнитин-ацетилтрансфераза имеет молекулярный вес в пределах 70 кДа, и содержит приблизительно 600 аминокислотных остатков. CRAT состоит из двух доменов — домена N и домена C, состоящих из 20 α-спиралей и 16 β-цепей. Домен N состоит из восьмицепочечного β-листа, по бокам которых располагаются 8 α-спиралей. 6 смешанных β-цепей и 11 α-спиралей образуют С-домен.
Если сравнивать строение ядер (кóра) двух доменов фермента, то наблюдается значительное сходство фолдинга пептидного остова, и это на то, что только 4 % аминокислот, входящих в состав этих пептидных остовов, соответствуют друг другу, т.е. имеют одинаковую последовательность[1].
Активный центр
Функцию каталитического центра CRAT выполняет остаток гистидина — His343[4]. Он расположен на стыке доменов C и N, почти в центре CRAT. Боковая цепь His343 расположена неравномерно, атомом азота δ1 гистидинового кольца соединяется водородной связью с карбонильным кислородом аминокислотного остова[1][5][6].
Центр связывания КоА
Поскольку CRAT связывает КоА, а не ацетил-КоА, можно сделать вывод, что CRAT обладает способностью гидролизовать ацетил-КоА до взаимодействия со свободной молекулой кофермента А на участке связывания. КоА связывается активным центром в линейной конформации, пантотеновой рукой (терминальной частью молекулы). Терминальная SH — тиоловая группа в так называемой пантотеновой руке и ε2 атом азота боковой цепи каталитического центра His343, образуют водородную связь. Между 3'-фосфатной группой на КоА и аминокислотными остатками Lys419 и Lys423 также происходит образование связей. Помимо этого, на участке связывания, остатки Asp430 и Glu453 образуют водородную связь друг с другом. Если какой-либо из аминокислотных остатков заменяется в результате мутации, то это может привести к снижению активности CRAT[7][8].
Карнитин связывающий центр
Карнитин связывается ферментом в частично сложенном виде, его функциональные группы (гидроксильная и карбоксильная) направлены в различные стороны. Сам участок связывания состоит из β-листа домена С и в особенности из аминокислотных остатков домена N. После связывания лицевая часть карнитина, остается открытой в пространстве находящимся вне фермента. Как и кофермент А, карнитин образует водородную связь с ε2 атомом азота на остаток His343. В случае карнитина связь образуется с 3-гидроксильной группой (3-OH). Катализ этого фермента стереоспецифичен для карнитина, так стереоизомер 3-ОН группы не может полноценно взаимодействовать с карнитин связывающим участком CRAT. Сам же фермент претерпевает незначительные конформационные изменения при связывании с карнитином[1][9][10].
Функции
.tiff.png.webp)
Аминокислотный остаток His343 активного центра фермента способен катализировать реакцию ацетилирования карнитина, посредством депротонирования терминальной (концевой) SH - тиоловой группы кофермента А или 3-ОН - гидроксильной группы карнитина в зависимости от направления реакции. Структура СRAT оптимизирует такие реакции, образовывая прямые водородные связи между остатком His343 и обоих субстратов (кофермента А и карнитина). После этого депротонированная группа может свободно атаковать ацетильную группу СоА или СOOH-группу ацетилкарнитина. Реакция протекает непосредственно, без образования His343-ацетил интермедиата (промежуточного продукта).
Гидролиз
Вполне возможно, что катализ может протекать только с одним из двух субстратов. Если какая-либо молекула ацетил-КоА или ацетилкарнитин связываются с CRAT, то молекулы воды могут занять другие участки связывания, а также ацетильную группу (СH3-CO) акцептора.
Субстрат-вспомогательный катализ
Существуют литературные данные, которые свидетельствуют о том, что -N+-(CH3)3- триметиламмониевая группа карнитина может быть решающим фактором в катализе CRAT. Триметиламмониевая группа проявляет положительный заряд, который стабилизирует оксианион в реакции получения интермедиата (промежуточного соединения). Эта мысль подтверждается тем фактом, что положительный заряд карнитина не является необходимым для активного связывания, но имеет жизненно важное значение продолжения протекания дальнейшего катализа. Это было доказано на примере катализа аналога карнитина с отсутствием триметиламмониевой группы. Такое соединение было в состоянии конкурировать с карнитином и связываться с CRAT, однако, оно не смогло вызвать реакцию[11] . Появление субстрат-вспомогательного катализа открывает новые стратегии для увеличения синтетической субстратной специфичности[12].
Медицинское значение
Те, кто унаследовал дефицит CRAT-активности, имеют повышенный риск развития тяжёлых сердечных и неврологических заболеваний[1].
Снижение активности фермента обнаруживается у лиц, страдающих болезнью Альцгеймера[1].
CRAT и его семейство ферментов, имеют большой потенциал в качестве целей для разработки терапевтических методов лечения диабета 2-го типа и других заболеваний[14][15][16].
Взаимодействия с другими белками
Известно, что CRAT взаимодействует с белками NEDD8, PEX5 и SUMO1[3].
Примечания
- Jogl G., Tong L. Crystal structure of carnitine acetyltransferase and implications for the catalytic mechanism and fatty acid transport (англ.) // Cell : journal. — Cell Press, 2003. — January (vol. 112, no. 1). — P. 113—122. — doi:10.1016/S0092-8674(02)01228-X. — PMID 12526798.
- Bieber L.L. Carnitine (англ.) // Annual Review of Biochemistry : journal. — 1988. — Vol. 57. — P. 261—283. — doi:10.1146/annurev.bi.57.070188.001401. — PMID 3052273.
- Entrez Gene: CRAT carnitine acetyltransferase.
- McGarry J.D., Brown N.F. The mitochondrial carnitine palmitoyltransferase system. From concept to molecular analysis (англ.) // European Journal of Biochemistry / FEBS : journal. — 1997. — February (vol. 244, no. 1). — P. 1—14. — doi:10.1111/j.1432-1033.1997.00001.x. — PMID 9063439.
- Jogl G., Hsiao Y.S., Tong L. Structure and function of carnitine acyltransferases (англ.) // Annals of the New York Academy of Sciences : journal. — 2004. — November (vol. 1033). — P. 17—29. — doi:10.1196/annals.1320.002. — PMID 15591000.
- Wu D., Govindasamy L., Lian W., Gu Y., Kukar T., Agbandje-McKenna M., McKenna R. Structure of human carnitine acetyltransferase. Molecular basis for fatty acyl transfer (англ.) // The Journal of Biological Chemistry : journal. — 2003. — April (vol. 278, no. 15). — P. 13159—13165. — doi:10.1074/jbc.M212356200. — PMID 12562770.
- Ramsay R.R., Gandour R.D., van der Leij F.R. Molecular enzymology of carnitine transfer and transport (англ.) // Biochimica et Biophysica Acta : journal. — 2001. — March (vol. 1546, no. 1). — P. 21—43. — doi:10.1016/S0167-4838(01)00147-9. — PMID 11257506.
- Hsiao Y.S., Jogl G., Tong L. Crystal structures of murine carnitine acetyltransferase in ternary complexes with its substrates (англ.) // The Journal of Biological Chemistry : journal. — 2006. — September (vol. 281, no. 38). — P. 28480—28487. — doi:10.1074/jbc.M602622200. — PMID 16870616.
- Cronin C.N. The conserved serine-threonine-serine motif of the carnitine acyltransferases is involved in carnitine binding and transition-state stabilization: a site-directed mutagenesis study (англ.) // Biochemical and Biophysical Research Communications : journal. — 1997. — September (vol. 238, no. 3). — P. 784—789. — doi:10.1006/bbrc.1997.7390. — PMID 9325168.
- Hsiao Y.S., Jogl G., Tong L. Structural and biochemical studies of the substrate selectivity of carnitine acetyltransferase (англ.) // The Journal of Biological Chemistry : journal. — 2004. — July (vol. 279, no. 30). — P. 31584—31589. — doi:10.1074/jbc.M403484200. — PMID 15155726.
- Saeed A., McMillin J.B., Wolkowicz P.E., Brouillette W.J. Carnitine acyltransferase enzymic catalysis requires a positive charge on the carnitine cofactor (англ.) // Archives of Biochemistry and Biophysics : journal. — Elsevier, 1993. — September (vol. 305, no. 2). — P. 307—312. — doi:10.1006/abbi.1993.1427. — PMID 8373168.
- Dall'Acqua W., Carter P. Substrate-assisted catalysis: molecular basis and biological significance (англ.) // Protein Science : journal. — 2000. — January (vol. 9, no. 1). — P. 1—9. — doi:10.1110/ps.9.1.1. — PMID 10739241.
- Brunner S., Kramar K., Denhardt D.T., Hofbauer R. Cloning and characterization of murine carnitine acetyltransferase: evidence for a requirement during cell cycle progression (англ.) // The Biochemical Journal : journal. — 1997. — March (vol. 322, no. 2). — P. 403—410. — doi:10.1042/bj3220403. — PMID 9065756.
- Anderson R.C. Carnitine palmitoyltransferase: a viable target for the treatment of NIDDM? (англ.) // Current Pharmaceutical Design : journal. — 1998. — February (vol. 4, no. 1). — P. 1—16. — PMID 10197030.
- Giannessi F., Chiodi P., Marzi M., Minetti P., Pessotto P., De Angelis F., Tassoni E., Conti R., Giorgi F., Mabilia M., Dell'Uomo N., Muck S., Tinti M.O., Carminati P., Arduini A. Reversible carnitine palmitoyltransferase inhibitors with broad chemical diversity as potential antidiabetic agents (англ.) // Journal of Medicinal Chemistry : journal. — 2001. — July (vol. 44, no. 15). — P. 2383—2386. — doi:10.1021/jm010889. — PMID 11448219.
- Wagman A.S., Nuss J.M. Current therapies and emerging targets for the treatment of diabetes (англ.) // Current Pharmaceutical Design : journal. — 2001. — April (vol. 7, no. 6). — P. 417—450. — doi:10.2174/1381612013397915. — PMID 11281851.