Ионные кристаллы
Ио́нные криста́ллы представляют собой кристаллы, состоящие из ионов, связанных между собой электростатическим притяжением. Примерами таких кристаллов являются галогениды щелочных металлов, в том числе фторид калия, хлорид калия, бромид калия, иодид калия, фторид натрия и другие комбинации ионов натрия, цезия, рубидия и лития с ионами фтора, брома, хлора и иода.[1]
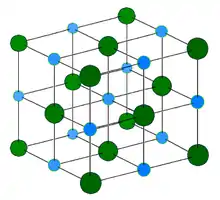
Светло-голубой = Na+
Тёмно-зелёный = Cl-
NaCl имеет расположение ионов по системе 6:6. Свойства NaCl отражают сильные взаимодействия, которые существуют между ионами. В расплавленном виде это хороший проводник электричества, но в твёрдом состоянии проводит ток плохо. При расплавлении подвижные ионы хорошо переносят заряд через жидкость.[2]
Ионные кристаллы характеризуются сильным поглощением инфракрасного излучения, и у них есть плоскости, вдоль которых они легко расщепляются. Точное расположение ионов в ионной решётке зависит от размера ионов в твердом состоянии.
Ионные кристаллы обычно имеют высокую температуру плавления и хорошо растворимы в полярных растворителях (в частности в воде).[3]
Примечания
- Ионные кристаллы. Архивировано 8 сентября 2012 года.
- Ionic Structures. Архивировано 8 сентября 2012 года.
- P.W. Atkins, T.L. Overton, J.P. Rourke, M.T. Weller, and F.A. Armstrong. Inorganic Chemistry. — Oxford University Press, 2010. — P. 77. — ISBN 978–1–42–921820–7.
Ссылки
- Art of the States: Anea musical work inspired by ionic crystals