Детерминация типов спаривания у дрожжей
Детермина́ция ти́пов спа́ривания у дрожже́й представляет собой генетический механизм, определяющий проявление того или иного типа спаривания у конкретной клетки дрожжей[1].
Наиболее подробно этот механизм был изучен у пекарских дрожжей — Saccharomyces cerevisiae. У S. cerevisiae в жизненном цикле присутствуют как диплоидная, так и гаплоидная (аскоспора) стадии. Детерминация типов спаривания происходит только у гаплоидных форм. Всего возможны два типа спаривания: a и α. Тип спаривания регулируется единственным локусом — MAT, ответственным за признаки, характерные для каждого полового типа. В ходе каждого клеточного цикла гаплоидная клетка может сменить пол путём особой формы генетической рекомбинации — конверсии генов (подробнее см. ниже)[2][3]. Механизм переключения типов спаривания у S. cerevisiae был предложен в конце 70-х гг. XX в. А. Херсковицем, Дж. Хиксом и Дж. Стразнером[1].
У другого вида дрожжей — Schiz. pombe[1] — также был обнаружен механизм переключения пола, подобный такому механизму у S. cerevisiae. Похожие механизмы определения пола действуют у некоторых базидиомицетов[4], однако у них имеется множество аллелей, ответственных за половой тип, а не только два, и число типов спаривания доходит до нескольких тысяч[5].
Типы спаривания и жизненный цикл S. cerevisiae
Как писалось выше, дрожжи S. cerevisiae могут существовать в гаплоидной и диплоидной стадиях. Обе формы способны размножаться почкованием, которому предшествует митоз, причём дочерняя клетка отпочковывается от материнской. Гаплоидные клетки, кроме того, способны сливаться с другими гаплоидными клетками противоположного типа спаривания (a-клетки с α-клетками, и наоборот), образуя стабильную диплоидную клетку. Диплоидные клетки, как правило, в стрессовых условиях (например, истощение ресурсов питательных веществ) могут подвергаться мейозу, давая начало четырём гаплоидным аскоспорам: двум a-спорам и двум α-спорам[3].
Различия между a- и α-клетками
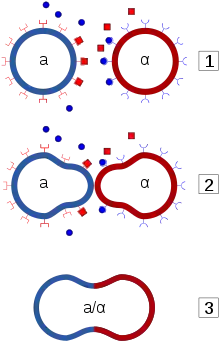
a-клетки выделяют a-фактор, феромон, сигнализирующий о присутствии a-клетки соседним α-клеткам. a-клетки, в свою очередь, реагируют на α-фактор, феромон α-клеток, разрастаясь в направлении источника α-фактора. Аналогичным образом ведут себя α-клетки. Это обеспечивает спаривание только гаплоидных клеток разных типов спаривания и делает невозможным спаривание клеток одного полового типа[6][2].
Фенотипические различия между a- и α-клетками обусловлены активной транскрипцией и подавлением различных наборов генов. Так, у a-клеток активны гены, ответственные за синтез a-фактора, а также гены, активирующие образование поверхностных клеточных рецепторов (STE2), которые связываются с α-фактором и подают всей клетке сигнал о присутствии α-клеток. a-клетки также подавляют гены, ответственные за фенотипические проявления α-типа. Аналогичным образом поступают α-клетки (их поверхностные клеточные рецепторы обозначаются как STE3)[2].
Подавление экспрессии определённых наборов генов на стадии транскрипции и активация других, характерные для a- и α-клеток, обусловлены наличием одного из двух аллелей локуса MAT: MATa и MATα. Аллель MATa заключает в себе ген a1, который в гаплоидной клетке определяет запуск a-специфичной транскрипционной программы (например, экспрессия STE2 и подавление экспрессии STE3), определяющей фенотип a-клетки. Аллель MATα заключает гены α1 и α2, которые в гаплоидной клетке определяет запуск α-специфичной транскрипционной программы (например, экспрессия STE3 и подавление экспрессии STE2), определяющей фенотип α-клетки.
Различия между гаплоидными и диплоидными клетками
Гаплоидные клетки имеют один из двух половых типов (a или α), реагируют на феромоны клеток противоположного полового типа и могут спариваться с ними. Гаплоидные клетки не могут подвергаться мейозу. Диплоидные клетки не образуют феромонов и не реагируют на них, не спариваются, но могут делиться мейозом с образованием четырёх гаплоидных клеток.
Подобно различиям между гаплоидными a- и α-клетками, за фенотипические различия между гаплоидными и диплоидными клетками также ответственны различные активация и репрессия различных наборов генов. Вдобавок к a- и α-специфичным транскрипционным программам, у гаплоидных клеток обоих типов работает специфичная транскрипционная программа, активирующая экспрессию специфичных для гаплоидов генов (например, HO) и подавляющая экспрессию генов, специфичных для диплоидных клеток (например, IME1). Аналогично диплоидные клетки активируют диплоидоспецифичные гены и подавляют гаплоидоспецифичные.
Экспрессия различных генов у гаплоидов и диплоидов опять-таки обусловлена локусом MAT. Гаплоидные клетки содержат лишь один набор из 16 хромосом и потому могут иметь лишь один аллель локуса MAT (или MATa, или MATα), определяющий их половой тип. Диплоидная клетка образуется в результате спаривания a- и α-клеток, а потому содержит 32 хромосомы в 16 парах, в том числе одну хромосомы с MATa-аллелем и одну с MATα-аллелем. Комбинация информации, закодированной аллелем MATa (ген a1) и аллелем MATα (гены α1 и α2), запускает транскрипционную программу, специфичную для диплоидных клеток. Аналогично наличие только одного аллеля MAT — MATa или MATα — запускает гаплоидоспецифичную транскрипционную программу.
Аллель локуса MAT содержит достаточно информации для полового поведения клеток. Например, с помощью генетических манипуляций в гаплоидную α-клетку с аллелем MATα можно добавить аллель MATa. Несмотря на то, что по остальным локусам клетка гаплоидна, она теперь содержит и MATα и MATa и диплоидна по локусу MAT, а потому будет вести себя как диплоидная клетка: не будет производить феромоны и реагировать на них, а при голодании попытается поделиться мейозом, что приведёт к фатальному результату из-за гаплоидности по остальным генам. Аналогично, если убрать у диплоидной клетки один аллель MAT, оставив или аллель MATα, или MATa, то диплоидная по остальным генам клетка будет вести себя как гаплоидная.
Переключение типа спаривания

Способные к спариванию дрожжи дикого типа способны к переключению типа спаривания между a и α. Поэтому, даже если в колонии дрожжей имеется всего одна гаплоидная клетка определённого типа спаривания, то переключение пола приведёт к тому, что в популяции будут наличествовать клетки как a-, так и α-типа. Благодаря стойкому стимулу гаплоидных клеток к спариванию с гаплоидными клетками противоположного полового типа, переключение пола и последующее спаривание приведёт к тому, что большинство клеток в колонии будут диплоидными, независимо от того, какие — диплоидные или гаплоидные — клетки были в ней сначала. Подавляющее большинство штаммов дрожжей, исследуемых в лабораториях, были изменены настолько, что утратили способность к переключению пола (из-за делеции гена HO; см. ниже). Это обеспечивает стабильное размножение гаплоидных клеток, так как гаплоидные клетки a-типа будут оставаться a-клетками (а клетки α-типа — α-клетками) и не будут давать диплоидов между собой.

HMR и HML: молчащие кассеты
Гаплоидные дрожжи переключают пол, заменяя информацию, содержащуюся в MAT-локусе. Например, a-клетки могут превращаться в α-клетки, заменяя аллель MATa на MATα. Такая замена одного аллеля MAT на другой возможна благодаря тому, что клетки дрожжей содержат дополнительную молчащую копию обоих аллелей: локус HML (от англ. Hidden MAT Left) обычно несёт молчащую копию аллеля MATα и располагается слева от локуса MAT, а HMR обычно (от англ. Hidden MAT Right) содержит молчащую копию MATa и находится справа от MAT. Молчащие локусы HMR и HML часто называются молчащими кассетами, поскольку их информация передаётся в активный локус MAT (поэтому сам механизм переключения пола у дрожжей называют кассетным[1]).
Дополнительные копии аллелей, ответственных за типы спаривания, не мешают функционированию локуса MAT, какой бы он аллель ни содержал, потому что они не экспрессируются, и гаплоидная клетка с аллелем MATa в локусе MAT остаётся a-клеткой, несмотря на наличие молчащего аллеля MATα в локусе HML. Транскрибируется только аллель, заключённый в локусе MAT, и только он влияет на поведение клетки.
Механизм переключения типа спаривания
Процесс переключения типа спаривания в сущности представляет собой конверсию генов, инициируемую геном НО. Ген НО строго регулируется гаплоидоспецифичным геном, активируемым только в гаплоидных клетках в G1-фазе клеточного цикла. Ген НО кодирует фермент ДНК-эндонуклеазу, который разрезает ДНК исключительно в районе локуса МАТ (поскольку НО-эндонуклеаза специфична к последовательности ДНК этого участка).
Как только НО-эндонуклеаза разрезает ДНК в локусе МАТ, к концам разрезаемой ДНК привлекаются экзонуклеазы и начинают разрушать ДНК по обе стороны от сайта разрезания. Эта деградация ДНК, осуществляемая экзонуклеазами, убирает ДНК, содержащуюся в аллеле МАТ. Однако этот разрыв репарируется при помощи ДНК, скопированной с HML или HMR, в результате вставляется аллель MATa или MATα. Таким образом, молчащие аллели MATa и MATα, имеющиеся в локусах HML и HMR, служат источником генетической информации для репарации НО-индуцированного повреждения ДНК в активном локусе МАТ. Клетки предпочитают сменить тип спаривания, то есть a-клетка с большей вероятностью вставит в место разрыва аллель MATα и станет α-клеткой, и наоборот. Механизм этой специфичности неизвестен.
Направленность переключения типа спаривания
Репарация МАТ-локуса после разрезания НО-эндонуклеазой практически всегда приводит к смене типа спаривания. Когда a-клетка разрезает аллель MATa в MAT-локусе, MAT практически всегда репарируется информацией с HML. Таким образом, MAT будет репарирован аллелью MATα, а тип спаривания сменится с a на α. Аналогично в α-клетке репарация почти всегда осуществляется с локуса HMR, из-за чего в MAT оказывается MATa, а тип спаривания переключается с α на a.
Причина подобной ошибки кроется в рекомбинационном энхансере (англ. recombination enhancer (RE))[7], находящемся на левом плече хромосомы III. Делеция этого региона вызывает некорректную репарацию в a-клетках, при которой в место разрыва вставляется копия HMR. В норме же у a-клеток с RE связывается транскрипционный фактор Mcm1, тем самым запуская конверсию с копированием и вставкой копии HML. У α-клеток фактор α2 связывается с RE и перекрывает его одним своим доменом, репрессируя его и тем самым подавляя конверсию. В действительности показано, что наиболее проблематичной является репарация с HMR. Конкретные механизмы описанных процессов ещё устанавливаются.
Регуляция
Информация, заключённая в кассетах (то есть генах HMRа и HMLα), не экспрессируется в гаплоидных клетках из-за наличия специальных последовательностей — глушителей (сайленсеров), влияющих на характер компактизации хроматина в кассетах. Глушители контролируются специальными генами SIR, локализованными в других хромосомах. Возле локуса MAT глушителей нет[1].
Примечания
- Инге-Вечтомов, 2010, с. 518—520.
- Beth A Montelone. Yeast Mating Type // ENCYCLOPEDIA OF LIFE SCIENCES. — 2002. — doi:10.1038/npg.els.0000598. (недоступная ссылка)
- Harvey Lodish, Arnold Berk, S Lawrence Zipursky, Paul Matsudaira, David Baltimore, James Darnell. Molecular Cell Biology. — 4th edition. — New York: W. H. Freeman, 2000. — ISBN 978-0-7167-3136-3.
- Jacques Labarère, Thierry Noel. Mating type switching in teterapolar basidiomycete Agrocybe aegerita // Genetics society of America. — 1992.
- Lorna A. Casselton, Natalie S. Olesnicky. Molecular Genetics of Mating Recognition in Basidiomycete Fungi // Microbiology and molecular biology reviews. — 1998. — № 62.
- Jane B. Reece, Lisa A. Urry, Michael L. Cain et. al. Campbell: Biology. — 9th edition.. — Benjamin Cummings. — P. 206—207. — 1263 p. — ISBN 978-0-321-55823-7.
- The Saccharomyces cerevisiae recombination enhancer biases recombination during interchromosomal mating-type switching but not in interchromosomal homologous recombination (англ.) // Genetics : journal. — 2004. — March (vol. 166, no. 3). — P. 1187—1197. — PMID 15082540.
Литература
- Инге-Вечтомов С.Г. Генетика с основами селекции. — СПб.: Издательство Н-Л, 2010. — 718 с. — ISBN 987-5-94869-105-3.