Дегидрогеназный комплекс разветвлённых α-кетокислот
Дегидрогеназный комплекс разветвлённых α-кетокислот, также дегидрогеназа α-кетокислот с разветвлённой цепью (англ. Branched-chain α-ketoacid dehydrogenase complex сокр. BCKDC или BCKDH комплекс) — мультиферментный комплекс, локализованный на внутренней мембране митохондрий[1]. Данный комплекс катализирует реакцию окислительного декарбоксилирования разветвлённых α-кетокислот с короткой углеродной цепью. Дегидрогеназный комплекс структурно аналогичен пируватдегидрогеназному и α-кетоглутаратдегидрогеназному комплексам, образуя вместе с ними семейство митохондриальных ферментов, участвующих в окислительном декарбоксилировании α-кетокислот.
Функции
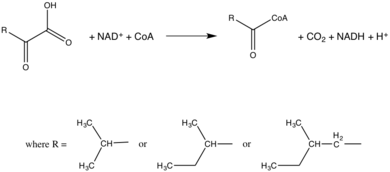
В тканях животных и человека данный комплекс катализирует необратимую стадию[2] катаболизма аминокислот с разветвлённой цепью (BCAA) — L-изолейцина, L-валина и L-лейцина, воздействуя на их дезаминированные производные (L-2-кето-3-метилвалерат, 2-кетоизовалерат и 2-кетоизокапроат соответственно), и превращая их в КоА-эфиры: α-метилбутирил-КоА, изобутирил-КоА и изовалерил-КоА соответственно[3] [4][5][6]. У бактерий этот ферментный комплекс участвует в синтезе разветвлённых длинноцепочечных жирных кислот[7]. У растений он участвует в синтезе разветвлённых длинноцепочечных углеводородов.
Структура
Данный комплекс состоит из трёх ферментных субъединиц (E1, E2 и Е3). Они используют в катализе следующие коферменты: тиаминпирофосфат, липоат, кофермент А, FAD и NAD+.
Ферменты Сокращение 3-Метил-2-оксобутаноат дегидрогеназа
Шаблон:N° EC : décarboxylaseE1 Тиаминпирофосфат
(TПФ)Дигидролипоилтрансацилаза
Шаблон:N° EC : acyltransféraseE2 Липоамид / Дигидролипоамид
Кофермент A(CoA-SH)Дигидролипоилдегидрогеназа
Шаблон:N° EC : oxydo-réductaseE3 Флавинадениндинуклеотид (FAD)
Никотинамидадениндинуклеотид (NAD+)
Субъединица Е1
Субъединица Е1 — 3-метил-2-оксобутаноат дегидрогеназа или дегидрогеназа разветвлённых α-кетокислот (КФ 1.2.4.4) использует в качестве кофермента тиаминпирофосфат (ТПФ). E1 катализирует как декарбоксилирование α-кетокислоты, так и последующее восстановительное ацилирование липоильной части (другого каталитического кофактора), ковалентно связанной с E2.
Субъединица Е2
Субъединица Е2 (КФ 2.3.1.168) — дегидролипоилтрансацилаза, катализирует перенос ацильной группы от липоильной на молекулу кофермента A (стехиометрический кофактор)[8].
Субъединица Е3
Субъединица Е3 или дегидролипоилдегидрогеназа (КФ 1.8.1.4) — представляет собой флавопротеин, и он повторно окисляет восстановленные липоилсерные остатки E2 с использованием FAD (каталитический кофактор) в качестве окислителя. Затем FAD передаёт протоны и электроны на NAD+ (стехиометрический кофактор) для завершения цикла реакции.
Механизм катализа
Как упоминалось ранее, основная функция дегидрогеназного комплекса у млекопитающих заключается в катализе необратимого этапа катаболизма аминокислот с разветвлённой цепью. Однако BCKDC имеет относительно широкую специфичность, также окисляя 4-метилтио-2-оксобутират и 2-оксобутират со сравнимыми скоростями и с аналогичными значениями Km, что и для его аминокислотных субстратов с разветвлённой цепью[9]. BCKDC также будет окислять пируват, но при такой медленной скорости эта побочная реакция имеет очень малое физиологическое значение[10][11].
Механизм реакции следующий[12]. Обратите внимание на то, что любая из нескольких α-кетокислот с разветвлённой цепью может быть использована в качестве исходного вещества; в этом примере α-кетоизовалерат был произвольно выбран в качестве субстрата дегидрогеназного комплекса.
ПРИМЕЧАНИЕ. Стадии 1 и 2 протекают в домене E1.
Стадия 1: α-кетоизовалерат объединяется с тиаминпирофосфатом (ТПФ) и затем декарбоксилируется.

Стадия 2: 2-метилтилпропанол-TПФ окисляется с образованием ацильной группы при одновременном переносе её на липоильный кофактор субъединицы E2. Обратите внимание, что TПФ регенерируется.

ПРИМЕЧАНИЕ: Ацилированное липоильное плечо теперь покидает E1 и переходит на активный сайт E2, где происходит стадия 3.
Стадия 3: На субъединице Е2 происходит перенос ацильной группы на молекулу кофермента А.
ПРИМЕЧАНИЕ: уменьшенное липоильное плечо теперь переходит на субъединицу E3, где происходят стадии 4 и 5.
Стадия 4: Окисление липоильной части коферментом FAD, как показано на рисунке.
Стадия 5: Реокисление молекул FADH2 до FAD с образованием NADH:
FADH2 + NAD+ = FAD + NADH•Н
Заболевания, связанные с дефектами комплекса
Дефицит любого из ферментов этого комплекса, а также ингибирование комплекса в целом приводит к накоплению в организме аминокислот с разветвлённой цепью и их производных, в частности кетокислот, которые приводят к патологии, известной как болезнь кленового сиропа или лейциноз. Кетокислоты придают специфический сладкий запах (схожий с карамелью или жжённым сахаром) выделениям организма (таким как ушная сера и моча), откуда и следует название заболевания[13]. Болезнь наследуется по аутосомно-рецессивному типу и относится к так называемым орфанным (редким) заболеваниям.
Данный ферментный комплекс является аутоантигеном (собственный антиген, который приобрёл чужеродную специфичность), распознаваемым при первичном билиарном циррозе, острой форме печеночной недостаточности. Антитела, по-видимому, распознают окисленный белок, возникший в результате воспалительных иммунных реакций. Некоторые из этих воспалительных реакций объясняются чувствительностью к глютену[14]. Другие митохондриальные аутоантигены включают пируватдегидрогеназу и оксоглутаратдегидрогеназу с разветвлённой цепью, которые являются антигенами, распознаваемыми антимитохондриальными антителами (AMA).
Примечания
- Indo I, Kitano A, Endo F, Akaboshi I, Matsuda I (1987). “Altered Kinetic Properties of the Branched-Chain Alpha-Keto Acid Dehydrogenase Complex Due to Mutation of the Beta-Subunit of the Branched-Chain Alpha-Keto Acid Decarboxylase (E1) Component in Lymphoblastoid Cells Derived from Patients with Maple Syrup Urine Disease”. J Clin Invest. 80 (1): 63—70. DOI:10.1172/JCI113064. PMC 442202. PMID 3597778.
- Yeaman SJ (1989). “The 2-oxo acid dehydrogenase complexes: recent advances”. Biochem. J. 257 (3): 625—632. DOI:10.1042/bj2570625. PMC 1135633. PMID 2649080.
- Rodwell, Vector. 29 // Harper's illustrated biochemistry. — USA : McGraw Hill, 2015. — P. 310. — ISBN 978-0-07-182537-5.
- Broquist HP, Trupin JS (1966). “Amino Acid Metabolism”. Annual Review of Biochemistry. 35: 231—247. DOI:10.1146/annurev.bi.35.070166.001311.
- Harris RA, Paxton R, Powell SM, Goodwin GW, Kuntz MJ, Han AC (1986). “Regulation of branched-chain alpha-ketoacid dehydrogenase complex by covalent modification”. Adv Enzyme Regul. 25: 219—237. DOI:10.1016/0065-2571(86)90016-6. PMID 3028049.
- Namba Y, Yoshizawa K, Ejima A, Hayashi T, Kaneda T (1969). “Coenzyme A- and nicotinamide adenine dinucleotide-dependent branched chain alpha-keto acid dehydrogenase. I. Purification and properties of the enzyme from Bacillus subtilis”. J Biol Chem. 244 (16): 4437—4447. DOI:10.1016/S0021-9258(18)94337-1. PMID 4308861.
- Lennarz WJ; et al. (1961). “The role of isoleucine in the biosynthesis of branched-chain fatty acids by micrococcus lysodeikticus”. Biochemical and Biophysical Research Communications. 6 (2): 1112—116. DOI:10.1016/0006-291X(61)90395-3. PMID 14463994.
- Heffelfinger SC, Sewell ET, Danner DJ (1983). “Identification of specific subunits of highly purified bovine liver branched-chain ketoacid dehydrogenase”. Biochemistry. 22 (24): 5519—5522. DOI:10.1021/bi00293a011. PMID 6652074.
- Jones SM, Yeaman SJ (1986). “Oxidative decarboxylation of 4-methylthio-2-oxobutyrate by branched-chain 2-oxo acid dehydrogenase complex”. Biochemical Journal. 237 (2): 621—623. DOI:10.1042/bj2370621. PMC 1147032. PMID 3800905.
- Pettit FH, Yeaman SJ, Reed LJ (1978). “Purification and characterization of branched chain alpha-keto acid dehydrogenase complex of bovine kidney”. Proceedings of the National Academy of Sciences of the United States of America. 75 (10): 4881—4885. DOI:10.1073/pnas.75.10.4881. PMC 336225. PMID 283398.
- Damuni Z, Merryfield ML, Humphreys JS, Reed LJ (1984). “Purification and properties of branched-chain alpha-keto acid dehydrogenase phosphatase from bovine kidney”. Proceedings of the National Academy of Sciences of the United States of America. 81 (14): 4335—4338. DOI:10.1073/pnas.81.14.4335. PMC 345583. PMID 6589597.
- Berg, Jeremy M., John L. Tymoczko, Lubert Stryer, and Lubert Stryer. Biochemistry. 6th ed. New York: W.H. Freeman, 2007. 478-79. Print.
- Podebrad F, Heil M, Reichert S, Mosandl A, Sewell AC, Böhles H (April 1999). “4,5-dimethyl-3-hydroxy-25H-furanone (sotolone)--the odour of maple syrup urine disease”. Journal of Inherited Metabolic Disease. 22 (2): 107—114. DOI:10.1023/A:1005433516026. PMID 10234605. Неизвестный параметр
|s2cid=(справка) - Leung PS, Rossaro L, Davis PA, et al. (2007). “Antimitochondrial antibodies in acute liver failure: Implications for primary biliary cirrhosis”. Hepatology. 46 (5): 1436—42. DOI:10.1002/hep.21828. PMC 3731127. PMID 17657817.