Аурамин
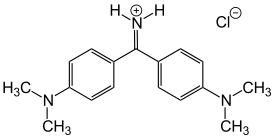
Аурамин — органическое соединение, диарилметановый основный краситель с химической формулой C17H22ClN3. Отличается чистой жёлтой окраской, обладает канцерогенными свойствами, в связи с которыми было прекращено его производство в СССР.
| Аурамин | |||
|---|---|---|---|
 | |||
| |||
| Общие | |||
| Систематическое наименование |
Аурамин | ||
| Хим. формула | C17H22ClN3 | ||
| Физические свойства | |||
| Молярная масса | 303,83 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | с разл., >250 °C | ||
| Классификация | |||
| Рег. номер CAS | [2465-27-2] | ||
| PubChem | 17170 | ||
| Рег. номер EINECS | 219-567-2 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 51876 | ||
| ChemSpider | 16254 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Синонимы: Auramine O, Basic Yellow 2, C.I. 41000, C.I. 655[1].
Физические свойства
Максимум длинноволновой полосы поглощения располагается при λmax = 420 нм. Вторая длинноволновая полоса поглощения, обусловленная разветвлённостью хромофорной системы, лежит в УФ-области, λmax = 372 нм, и не оказывает влияния на окраску.
Химические свойства
Аурамин нестоек к гидролизу, под действием воды при температуре выше 70 °C превращается в кетон Михлера (см ниже), поэтому крашение Аурамином возможно при температуре не выше 50—60 °C. Катион красителя удерживается на окрашенном субстрате амфотерного (белковые и полиамидные волокна) или кислотного (ацетатные, полиэфирные, целлюлозные с танниновой протравой волокна) характера главным образом за счёт ионного взаимодействия с кислотными — сульфо- и карбоксильными — группами материала.
Получение
Аурамин получают взаимодействием бис(диметиламино)производных бензофенона или тиобензофенона с аммиаком или солями аммония.
Например, фосгенированием N,N-диметиланилина получают кетон Михлера, который затем сплавляют с хлоридом аммония в присутствии безводного ZnCl2.
.gif)
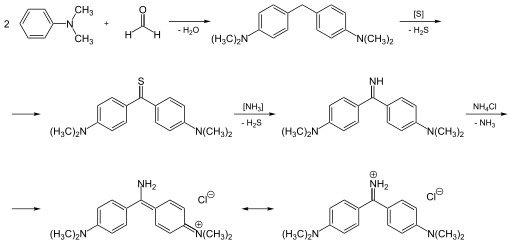
Другой способ заключается в конденсации диметиланилина с формальдегидом, за которым следует нагревание полученного производного дифенилметана до 160—200 °C в токе сухого аммиака с серой и сухим NH4Cl в присутствии большого количества сухого NaCl. NaCl в количестве 10 частей на 1 часть замещённого дифенилметана создаёт развитую поверхность соприкосновения реагентов с газообразным аммиаком.
Первоначально образующийся тиоаналог (то есть отличие в атоме серы вместо кислорода) кетона Михлера реагирует далее с NH3 и хлоридом аммония.
Примечания
- Венкатараман, 1957, с. 805.
Литература
- Венкатараман К. Химия синтетических красителей. — Л.: Государственное научно-техническое издательство химической литературы, 1957. — Т. 2.
- Степанов Б. И. Введение в химию и технологию органических красителей. — изд. 3-е, перераб. и доп.. — М.: Химия, 1984.

