mCherry
mCherry — белок, входящий в группу мономерных красных флуоресцентных белков mFruits. Его природный белок-предшественник DsRed (RFP) был выделен из кораллов рода Discosoma отряда морских анемон[1]. В отличие от DsRed mCherry является мономерным белком и его флуоресценция более стабильна, чем у его природного предшественника. Флуоресцентные белки применяются как клеточные метки для биологических исследований с помощью флуоресцентной микроскопии. mCherry поглощает свет в районе 540—590 нм и испускает свет в районе 550—650 нм[2]. mCherry входит в семейство флуорецентных белковых флуорофоров, использующихся для экспериментальной визуализации генов и анализа их функций. Редактирование генома позволило с высокой точностью вводить эти флуоресцентные тэги в геном многих модельных организмов[3].
Разработка
Красный флуоресцентный белок DsRed, выделенный из морской анемоны Discosoma, является тетрамерным белком[1]. Именно на его основе было создано большинство красных флуоресцентных белков. Однако, кроме относительно сложной тетрамерной структуры, DsRed обладает также низкой фотоустойчивостью к облучению и продолжительным временем созревания. Первоначально из DsRed был получен производный мономерный флуоресцентный белок mRFP1. Далее в ходе направленной эволюции канадским биологом Робертом Кемпбелом из Альбертского университета был получен белок второго поколения mCherry[1]. В дальнейшем из mRFP1 были также получены аналогичные белки с различными спектрами флуоресценции (т. н. mFruits), обладавшими, кроме мономерной структуры, также высокой фотостабильностью, более быстрым созреванием, высокой устойчивостью к различной кислотности среды. mCherry обладает спектрами с наиболее длинноволновыми максимумами поглощения и эмиссии в группе, но более низким квантовым выходом по сравнению с mRFP1[1].
Структура
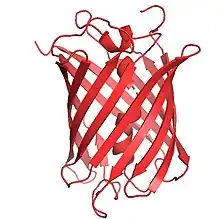
Ген mCherry содержит 711 пар оснований[4]. Белок включает 236 аминокислот, молекулярная масса 26,7 кДа[5]. В 2006 году была разрешена кристаллическая структура белка[6]. Вторичная структура mCherry включает 3 альфа-спирали и 13 β-складчатых слоёв, которые образуют β-цилиндр третичной структуры. Хромофор mCherry образуется из метионина-66, тирозина-67 и глицина-68, которые в процессе пост-трансляционной модификации формируют производнное имидазолинона[1]. Конъюгация пи-электрона придаёт белку поглощение и эмиссию с красным сдвигом[7]. Хромофор образуется из аминокислот, входящих в альфа-спираль, и локализуется внутри β-цилиндра, что защищает хромофор от окрущающей среды[7]. В целом окружение хромофора в mCherry более гидрофобная, чем в родительском белке DsRed[8]. Оба конца белка были сделаны по подобию GFP, что позволяет вводить его во многие опытные системы и модели[1].
Третичная структура белка похожа на структуру зелёного флуоресцентного белка (GFP)[9].
См. также
Примечания
- Shaner, Nathan C; Campbell, Robert E; Steinbach, Paul A; Giepmans, Ben N G; Palmer, Amy E; Tsien, Roger Y. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein (англ.) // Nature Biotechnology. — Nature Publishing Group, 2004. — 21 ноября (т. 22, № 12). — С. 1567—1572. — ISSN 1087-0156. — doi:10.1038/nbt1037. — PMID 15558047.
- Shu, Xiaokun; Shaner, Nathan C.; Yarbrough, Corinne A.; Tsien, Roger Y.; Remington, S. James. Novel Chromophores and Buried Charges Control Color in mFruits†,‡ (англ.) // Biochemistry : journal. — 2006. — August (vol. 45, no. 32). — P. 9639—9647. — ISSN 0006-2960. — doi:10.1021/bi060773l. — PMID 16893165.
- Heppert, Jennifer K.; Dickinson, Daniel J.; Pani, Ariel M.; Higgins, Christopher D.; Steward, Annette; Ahringer, Julie; Kuhn, Jeffrey R.; Goldstein, Bob. Comparative assessment of fluorescent proteins for in vivo imaging in an animal model system (англ.) // Molecular Biology of the Cell : journal. — 2016. — 7 November (vol. 27, no. 22). — P. 3385—3394. — ISSN 1059-1524. — doi:10.1091/mbc.e16-01-0063. — PMID 27385332.
- Addgene - Analyze Sequence (англ.). www.addgene.org. Дата обращения: 11 ноября 2018.
- mCherry - MCherry fluorescent protein - Anaplasma marginale - mCherry gene & protein (англ.). www.uniprot.org. Дата обращения: 11 ноября 2018.
- Shu, X.; Remington, S.J. Crystal structure of mCherry (англ.) : journal. — 2006. — 22 August. — doi:10.2210/pdb2h5q/pdb.
- Miyawaki, Atsushi; Shcherbakova, Daria M; Verkhusha, Vladislav V. Red fluorescent proteins: chromophore formation and cellular applications (англ.) // Current Opinion in Structural Biology : journal. — 2012. — October (vol. 22, no. 5). — P. 679—688. — ISSN 0959-440X. — doi:10.1016/j.sbi.2012.09.002. — PMID 23000031.
- Subach, Fedor V.; Verkhusha, Vladislav V. Chromophore Transformations in Red Fluorescent Proteins (англ.) // Chemical Reviews : journal. — 2012. — 11 July (vol. 112, no. 7). — P. 4308—4327. — ISSN 0009-2665. — doi:10.1021/cr2001965. — PMID 22559232.
- ZEISS Microscopy Online Campus | Anthozoa Fluorescent Proteins (англ.). zeiss-campus.magnet.fsu.edu. Дата обращения: 15 ноября 2018.
Ссылки
- FPbase. mCherry (англ.)
- FPbase. Fluorescent Protein Table (англ.)
