Холин-О-ацетилтрансфераза
Холин-О-ацетилтрансфераза, также холин-ацетилтрансфераза, холинацетил-СоА-трансфераза (англ. Choline acetyltransferase, сокр. СhAT, ХАТ, но иногда и CAT, КФ 2.3.1.6) — фермент из семейства ацилтрансфераз (тип трансфераз), катализирующий реакцию переноса ацетильной группы (CH3-CO) от молекулы ацетил-CoA на молекулу субстрата — холина, с образованием ацетилхолина (АЦХ) и кофермента А, по уравнению:
- ацетил-СоА + холин ацетилхолин + CoA-SH.
| Холин-О-ацетилтрансфераза | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 2.3.1.6 |
| Номер CAS | 9012-78-6 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9012-78-6 |
Фермент катализирует очень важную реакцию, образовавшийся ацетилхолин выполняет роль нейромедиатора. Как и большинство белков нервных окончаний, СhAT синтезируется в теле нейрона (соме) и затем транспортируется в нервные терминали (окончания), где он имеет самую высокую концентрацию. Наличие данного фермента в нервных клетках, классифицирует такую клетку, как "холинергический" нейрон. В организме человека фермент холин-ацетилтрансфераза кодируется геном СHAT, локализованный в 10-й хромосоме[1]. Белок состоит из последовательности 748 аминокислотных остатков и имеет молекулярную массу 82536 Да[2].
Исследования последних двух десятилетий свидетельствуют о существовании одного гена ChAT, в котором закодировано несколько форм и изоформ фермента[3].
Структура
3D структура ChAT была получена с помощью рентгеновской кристаллографии PDB:2FY2. Холин связывается в активном центре фермента нековалетно, между положительно заряженной аминогруппой холина и гидроксильной группой остатка тирозина — Tyr552, помимо этого происходит образование водородных связей между гидроксильной группы холина и остатка гистидина — His324.
Холин как субстрат размещается в кармане внутренней части ChAT, в то время как ацетил-CoA размещён в кармане на поверхности белка. Трёхмерная кристаллическая структура фермента показывает, что ацетильная группа молекулы ацетил-CoA примыкает к холинсвязывающему карману — минимизируя расстояние между ацетильной группой донора и акцептора.
- Структура связывающего участка холин-ацетилтрансферазы
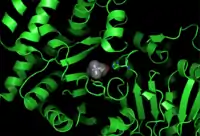 Кристаллическая структура иона холина, который связывается в холин-ацетилтрансферазе. Показаны боковые цепи остатков аминокислот His324A и Tyr552A.
Кристаллическая структура иона холина, который связывается в холин-ацетилтрансферазе. Показаны боковые цепи остатков аминокислот His324A и Tyr552A.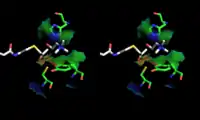 Стереоскопическое изображение холина и ацетил-CoA в активном центре ChAT.
Стереоскопическое изображение холина и ацетил-CoA в активном центре ChAT. Стереоскопическое изображение связывания молекулы холина и ацетил-CoA в активном центре ChAT — вид с альтернативного угла.
Стереоскопическое изображение связывания молекулы холина и ацетил-CoA в активном центре ChAT — вид с альтернативного угла.
Гомология
ChAT очень консервативна среди генома животных. В частности у млекопитающих имеется очень высокое сходство последовательностей. Человек и кошка, например, имеют 89 % идентичность последовательности ChAT. Идентичность последовательности с дрозофилой составляет около 30 %[4].
Формы фермента
Существуют две формы фермента: растворимая и мембранно-связанная[5]. Растворимая форма составляет 80-90 % от общей активности фермента, в то время как связанная с мембраной форма отвечает за остальные 10-20 % активности[6]. Тем не менее, уже давно существуют дебаты о том, как последняя форма ChAT связана с мембраной[7]. В мембранно-связанной форме ChAT ассоциирован с синаптическими везикулами[8].
Общие и периферические изоформы ChAT
Существуют две изоформы ChAT, обе закодированные в одной и той же последовательности. Общая изоформа ChAT (cChAT) присутствуют как в ЦНС, так и в ПНС. Периферическая изоформа ChAT (pChAT) преимущественно локализуется в ПНС организма человека, и возникает из-за пропуска экзона (экзоны 6-9) гена СHAT во время пост-транскрипционной модификации. Таким образом, аминокислотные последовательности очень похожи, однако, в pChAT отсутствуют части последовательности, присутствующие в cChAT.
Функции
Холинергические системы мозга представляют неизменный интерес нейробиологов в связи с их важной ролью в когнитивных функциях, функциях внимания и моторики. Дисфункция и дегенерация холинергических проекционных нейронов из подкорковых ядер переднего мозга, иннервирующих неокортекс и гиппокамп, лежит в основе патогенеза таких заболеваний, как болезнь Альцгеймера и Деменция с тельцами Леви, а также и других нервно-психических заболеваний, течение которых часто осложняется нарушениями в когнитивной сфере, таких как шизофрения, болезнь Паркинсона, сосудистая деменция при хронической ишемии головного мозга [3][9][10][11][12][13][14][15].
Низкая экспрессия ChAT в холинергических нейронах моторных ядер спинного мозга является специфическим ранним признаком амиотрофического бокового склероза, множественные аномалии холинергической функции в моторных ядрах спинного мозга составляют этиологию врожденного миастенического синдрома, дисфункция холинергических интернейронов неостриатума несёт частичную ответственность за непроизвольные движения при болезни Харрингтона[12][16][17].
В нервных окончаниях активность ChAT тесно связана с нейромедиаторной холинергической функцией. Долгое время, на основании кинетических расчетов, ChAT не относили к скорость-лимитирующим ферментам. По своим кинетическим характеристикам ХАТ не насыщается субстратами, холином и ацетил-CoA, в их физиологических концентрациях и поэтому считалось, что скорость синтеза зависела только от колебаний в уровне самих субстратов[18][19]. Однако в последние десятилетия было выявлено множество других внутриклеточных факторов регуляции активности фермента, и эти данные свидетельствовали о важной регулирующей роли ChAT в синтезе ацетилхолина[20][21]. Предполагается, что причиной ряда заболеваний являются спонтанные точечные мутации в молекуле ХАТ или её регуляторных белков, приводящие к дизрегуляции фермента или изменению способности к коммуникации с регуляторными факторами[17][21]. Эти факты побуждают к интенсивному исследованию нейрональных, генетических и постгеномных, регуляторных механизмов метаболизма и секреторной активности ацетилхолина.
ChAT долго была общепризнана только как цитоплазматический, водорастворимый фермент, даже после того, как в 1967 году была обнаружена на синаптических мембранах. Позже было доказано существование ChAT как интегрального структурного белка. Многолетнее изучение in vitro свойств синаптической водорастворимой (с, синаптоплазматической) и мембраносвязанной (м) ChAT в разных функционально-метаболических условиях показало, что связь между активностью ChAT и холинергической секреторной функцией зависит от компартментализации фермента. Исследования такого рода in vivo отсутствуют.
Медицинское значение
Примечания
- Strauss W.L., Kemper R.R., Jayakar P., Kong C.F., Hersh L.B., Hilt D.C., Rabin M. Human choline acetyltransferase gene maps to region 10q11-q22.2 by in situ hybridization (англ.) // Genomics : journal. — 1991. — February (vol. 9, no. 2). — P. 396—398. — doi:10.1016/0888-7543(91)90273-H. — PMID 1840566.
- UniProt, P28329 (англ.). Дата обращения: 18 марта 2018.
- Gill S.K., Ishak M., Dobransky T. et al. 82-kDa choline acetyltransferase is in nuclei of cholinergic neurons in human CNS and altered in aging and Alzheimer disease // Neurobiol. Aging. — 2007. — Vol. 28, №7. — P. 1028—1040.
- Oda Y. Choline acetyltransferase: the structure, distribution and pathologic changes in the central nervous system. (англ.) // Pathology international : journal. — 1999. — November (vol. 49, no. 11). — P. 921—937. — doi:10.1046/j.1440-1827.1999.00977.x. — PMID 10594838.
- Tandon A., Bachoo M., Weldon P., Polosa C., Collier B. Effects of colchicine application to preganglionic axons on choline acetyltransferase activity and acetylcholine content and release in the superior cervical ganglion (англ.) // Journal of Neurochemistry : journal. — 1996. — Vol. 66, no. 3. — P. 1033—1041. — doi:10.1046/j.1471-4159.1996.66031033.x. — PMID 8769864.
- Pahud G., Salem N., van de Goor J., Medilanski J., Pellegrinelli N., Eder-Colli L. Study of subcellular localization of membrane-bound choline acetyltransferase in Drosophila central nervous system and its association with membranes (англ.) // European Journal of Neuroscience : journal. — 1998. — 25 May (vol. 10, no. 5). — P. 1644—1653. — doi:10.1046/j.1460-9568.1998.00177.x. — PMID 9751137.
- Bruce G., Hersh L.B. Studies on detergent released choline acetyltransferase from membrane fractions of rat and human brain. (англ.) // Neurochemical Research : journal. — 1987. — December (vol. 12, no. 12). — P. 1059—1066. — doi:10.1007/bf00971705. — PMID 2450285.
- Carroll P.T. Membrane-bound choline-O-acetyltransferase in rat hippocampal tissue is associated with synaptic vesicles (англ.) // Brain Research : journal. — 1994. — Vol. 633, no. 1—2. — P. 112—118. — doi:10.1016/0006-8993(94)91529-6. — PMID 8137149.
- Захаров В.В., Хатиашвили И.Т., Яхно Н.Н. Деменция с тельцами Леви // Неврологический журнал. — 1998. — №6 . —С. 7—11.
- Dobransky T., Brewer D., Lajoie G. et al. Phosphorylation of 69-kD choline acetyltransferase at threonine-456 in response to short-term exposure to amyloid-b peptide 1-42 // J. Biol. Chem. —2003. — Vol. 278, №8 . — P. 5883—5893.
- Nardone R., De Blasi .P, Seidl M. et al. Cognitive function and cholinergic transmission in patients with subcortical vascular dementia and microbleeds: a TMS study // J. Neural Transm. — 2011. — Vol. 118, №9. — Р. 1349—1358.
- Oda Y. Choline acetyltransferase: the structure, distribution and pathologic changes in the central nervous system // Pathol. Int. —1999. — Vol. 49, №11. — P. 921—937.
- Shin J., Choi S., Lee J.E. et al. Subcortical white matter hyperintensities within the cholinergic pathways of Parkinson’s disease patients according to cognitive status // J. Neurol. Neurosurg Psychiatry. — 2012. — Vol. 83, №3. — P. 315—321.
- Wang J., Zhang H.Y., Tang X.C. Cholinergic deficiency involved in vascular dementia: possible mechanism and strategy of treatment// Acta Pharmacol. Sin. — 2009. — Vol. 30, №7. — P. 879—888.
- Yarnall A., Rochester L., Burn D.J. The interplay of cholinergic function, attention, and falls in Parkinson’s disease // Mov. Disord.— 2011. — Vol. 26, №14. — P. 2496—2503.
- Dobransky T., Doherty—Kirby A., Kim A.R. et al. Protein kinase-Cisoforms differentially phosphorylate human choline acetyltransferase regulating its catalytic activity // J. Biol. Chem. — 2004. — Vol. 279, №50. — P. 52059—52068.
- Ohno K., Tsujino A., Brengman J.M. et al. Choline acetyltransferasemutations cause myasthenic syndrome associated with episodic apnea in humans // Proc. Natl. Acad. Sci. USA. — 2001. — Vol. 98. — P. 2017—2022.
- Tucek S. Regulation of Acetylcholine Synthesis in the Brain // J. Neurochem. — 1985. — Vol. 44, №1. — P. 11—24.
- Tecek S. The synthesis of acetylcholine: Twenty years of progress // Prog. Brain Res. — 1990. — Vol. 84. — P. 467—477.
- Dobransky T., Rylett R.J. Functional regulation of choline acetyltransferase by phosphorylation // Neurochem Res. — 2003. — Vol. 28, №3—4. — P. 537—542.
- Dobransky T., Rylett R.J. Protein kinase C isoforms differentially phosphorylate human choline acetyltransferase regulating its catalytic activity // J. Neurochem. — 2005. — Vol. 95, №2. — P. 305—313.
