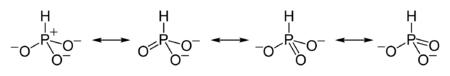Фосфиты
Фосфиты — соли фосфористой кислоты Н3РО3. Анион фосфористой кислоты (HPO32−) является многоатомным ионом, в котором центральным атомом является атом фосфора в степени окисления +3[1]. Его молекулярная геометрия приблизительно тетраэдрическая[2].
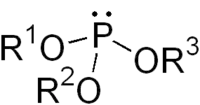 Структура типичного фосфита
Структура типичного фосфита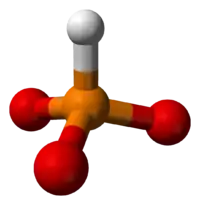 3D-модель фосфит-иона
3D-модель фосфит-иона
Связывание может быть объяснено с помощью резонансных структур (существует три эквивалентые структуры, содержащие одну двойную связь), эффективно делокализующих отрицательные заряды между эквивалентными атомами кислорода. Четыре резонансные структуры фосфит-иона:
Множество солей фосфористой кислоты, такие как фосфит аммония, очень хорошо растворимы в воде. Иногда название фосфиты относят также к эфирам этой кислоты, фосфорорганическим соединениям с формулой P(OR)3.
Фосфористая кислота
Фосфористая кислота является сопряженной кислотой фосфит-аниона (H3PO3 или HPO(OH)2). Также эта кислота называется ортофосфористой или оксидом дигидроксифосфина. Фосфористая кислота является двухосновной кислотой, так как один из атомов водорода связан напрямую с центральным атомом фосфора и не может быть ионизирован. Таким образом, более логичной химической формулой будет HPO(OH)2, так как только две гидроксильные группы действительно присутствуют в молекуле кислоты.
Кислые фосфиты
Кислые фосфиты (гидрофосфиты), такие как NH4HPO2OH, могут быть получены из фосфористой кислоты, HPO(OH)2[1]. Водородные связи между анионами приводят к образованию полимерных анионных структур[2]. По реакции фосфористой кислоты с карбонатами металлов были получены такие соли как RbHPHO3, CsHPHO3, TlHPHO3. Эти соединения содержат полимерный слой анионов, состоящий из тетраэдров HPO3, связанных водородными связями. Между такими слоями расположены слои катионов металлов[3].
Пирофосфиты
Пирофосфиты (дифосфиты) могут быть получены мягким нагреванием гидрофосфитов при пониженном давлением. Они содержат ион H2P2O52−, который правильнее записывать как [HPO2O−PO2H]2−[1][2].
См. также
Примечания
- Greenwood, Norman N.; Earnshaw, Alan. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-08-037941-9
- Crystal chemistry of inorganic phosphites, J. Loub, Acta Cryst. (1991), B47, 468—473, doi:10.1107/S0108768191002380
- Kosterina, E. V., Troyanov, S. I., Kemnitz, E. & Aslanov, L. A. Synthesis and Crystal Structure of Acid Phosphites RbH2PO3, CsH2PO3, and TlH2PO3 (англ.) // Russian Journal of Coordination Chemistry : journal. — 2001. — Vol. 27. — P. 458—462. — doi:10.1023/A:1011377229855.