Тетрил
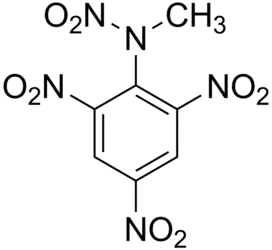
Тетрил — C6H2(NO2)3N(CH3)NO2 - мощное взрывчатое вещество, по взрывчатым характеристикам относится к вторичным (бризантным).
| Тетрил | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
2,4,6-тринитрофенил-N-метилнитрамин |
| Традиционные названия | Тетрил, нитрамин, тетралит |
| Хим. формула | (NO2)3C6H2N(NO2)CH3 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 287,15 г/моль |
| Плотность | 1,57 ± 0,01 г/см³[1] |
| Термические свойства | |
| Температура | |
| • плавления | 129,5 °C |
| • разложения | 187 °C |
| Давление пара | 1 ± 1 мм рт.ст.[1] |
| Классификация | |
| Рег. номер CAS | 479-45-8 |
| PubChem | 10178 |
| Рег. номер EINECS | 207-531-9 |
| SMILES | |
| InChI | |
| RTECS | BY6300000 |
| ChEBI | 28950 |
| Номер ООН | 0208 |
| ChemSpider | 9770 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Синонимы: 2,4,6-тринитро-N-метил-N-нитроанилин; N-метил-2,4,6-тринитрофенилнитрамин; метилпикрилнитрамин; N-метил-N,2,4,6-тетранитроанилин. Товарные наименования: тетрил, нитрамин, тетралит.
Физико-химические свойства
Кристаллическое вещество белого цвета. Но цвет технического продукта светло-желтый, обусловлен примесями. Хорошо растворим в ацетоне, концентрированной азотной кислоте и бензоле, хуже - в спирте и дихлорэтане. Практически не растворим в воде. Негигроскопичен. Реагирует со щелочами и карбонатами натрия и калия. При нагревании в слабых растворах щелочей образует пикраты. В конц.(?) H2SO4 разлагается до метилпикрамида. Реагирует с анилином в бензоле, образуя метилнитрамин и 2-, 4-, 6-тринитродифениламин. Чистый продукт стоек по отношению к слабым кислотам и не взаимодействует с аммиачной селитрой. Технический продукт из-за примеси пикриновой кислоты корродирует обычную сталь и несовместим с аммиачной селитрой. При сплавлении с тротилом образует аддукт с t пл. 68°С. Вследствие наличия нитрогрупп может образовывать производные с металлами карминно-красного цвета, которые являются высокочувствительными взрывчатыми веществами с температурой вспышки 95-105 С. Токсичен, при систематическом контакте вызывает аллергию или экзему на коже, окрашивает кожу в красный цвет, требует принятия специальных мер защиты при обращении. Химическая стойкость ниже, чем у тротила и некоторых других нитросоединений, но достаточна для длительного хранения при нормальных условиях. Легко прессуется до высокой плотности (1,71 г/см3 при 2000 кгс/см² ). Плотность кристаллического – 1,73 г/см3, обычная плотность в зарядах – 1,63 г/см3 Твёрдость по Моосу - менее 1,0.
В 100 см3 растворяется тетрила в граммах:
| Температура | Вода | Бензол | Ацетон | Дихлорэтилен | Спирт | CCl4 | Эфир | Сероуглерод |
|---|---|---|---|---|---|---|---|---|
| 0°С | 0,005 | 3,45 | — | 1,5 | 0,32 | 0,007 | 0,188 | 0,009 |
| 17°С | 0,007 | — | — | — | 0,49 | 0,02 | — | 0.017 |
| 20°С | 0,008 | 9,99 | 45,82 | 3,8 | 0,56 | 0,025 | 0,418 | 0,021 |
| 30°С | 0,008 | — | — | — | 0,76 | 0,039 | 0,493 | 0,029 |
| 40°С | 0,011 | — | — | 7,7 | 1,12 | 0,058 | — | 0,056 |
| 45°С | 0,014 | — | — | — | 1,38 | 0,073 | — | 0,094 |
| 50°С | 0,019 | — | 111,85 | — | 1,72 | 0,095 | — | — |
| 60°С | 0,035 | — | — | 18,8 | 2,64 | 0,154 | — | — |
| 70°С | 0,053 | 21,86 | — | — | 4,23 | 0,241 | — | — |
| 75°С | 0,066 | — | — | — | 5,33 | 0,247 | — | — |
| 80°С | 0,081 | 42,43 | — | 64,5 | — | — | — | — |
| 100°С | 0,184 | — | — | — | — | — | — | — |
Восприимчивость к нагреванию и внешним воздействиям
Температура плавления - 129,5°С с разложением (технический плавится при 128,8°С). Термически стабилен до 100°С. t всп. (?) - ок. 190°С (у тротила - 290°С, у ТНФ - 310°С). При 190°С быстро с шумом сгорает светлым ярким пламенем. Более мощное и чувствительное ВВ, чем тротил или пикриновая кислота.
Химическая стойкость: чистый продукт выдерживает пробу Эбля при 80°С не более 50 мин. Такая нестойкость объясняется примесью тетранитрофенилметилнитрамина(m-нитротетрила), который образуется из содержащегося в диметиланилине монометиланилина и уже кипящей водой гидролизуется на кислый тринитрофенилметилнитраминофенол и азотистую кислоту.
Чувствительность к удару: для груза 2,5 кг (50%-я вероятность детонации) - 37 см, (гексоген – 28 см, тротил – 148 см). Для груза 10 кг (высота 25 см) 50-60%-я вероятность взрыва, (тротил - 4-8 %, гексоген - 70-80 %).
Восприимчивость к детонации: 0,29 г для гремучей ртути, 0,09 г для ТА, 0,05 г для ГМТД или 0,03 г для азида свинца.
Взрывчатые характеристики
- Теплота взрыва: 4,6 МДж/кг (960 ккал/кг при 0,98 г/см3, 1160 ккал/кг при 1,69 г/см3).
- Теплота образования: +7.6 ккал/моль.
- Энтальпия образования: +16,7 ккал/кг.
- Температура взрыва: 2950 Кельвинов (примерно 2676°С).
- Скорость детонации: 7500 м/с при плотности 1,63 г/см3. При 1,70 г/см3 скорость детонации - 7620 м/с, а давление на фронте детонационной волны - 25 ГПа, (тротил 19 ГПа, гексоген - 34,7 ГПа (при 1,6 и 1,8 г/см3, соответственно)).
- Бризантность: 113-123 % (54-59 г) от тротила (48 г) по песочной пробе. Обжатие свинцовых столбиков - 19 мм (тол - 16,5 мм).
- Фугасность в Pb-блоке: 390 мл для химически чистого тетрила, и 340 мл для технического продукта (техпродукт содержит низкоплавкие примеси и обладает меньшей энергией). Для сравнения: тротил – 285 мл, ТЭН – 500 мл.
- Работоспособность в баллистической мортире: 126-132 % от тротила.
- Объем продуктов взрыва: 765 л/кг.
Получение
Тетрил обычно получают нитрованием диметиланилина. При приливании диметиланилина к конц. азотной кислоте происходит самовоспламенение. В промышленности тетрил получают растворением диметиланилина в избытке 92-96%-й серной кислоты (обычно 1 ч диметиланилина на 8-14 ч 96%-й серной кислоты) и нитрованием полученного раствора сульфата диметиланилина конц. азотной кислотой или меланжем. Реакция сопровождается окислением одной метиловой группы и большим тепловыделением. На протяжении всего процесса следует тщательно контролировать ход реакции и температуру, иначе возможно осмоление диметиланилина или даже вспышка. В Германии во время 2 мировой войны тетрил производили из динитрохлорбензола, обработкой его водным раствором метиламина и нитрованием полученного динитрометиланилина нитрующей смесью до тетрила. Этот способ был более безопасен и позволяет использовать динитрохлорбензол – широко доступное сырье.
Очень чистый тетрил может быть получен нитрованием диметиланилина большим избытком азотной кислоты плотностью 1,4 (65 %). Для этого 1 часть диметиланилина растворяют в 40 частях азотной кислоты при температуре до 7°С. Затем температуру осторожно повышают до 60°С, а по завершении относительно бурной реакции окисления нагревают до 90°С. По охлаждении выделяется тетрил с 78%-м выходом.
Также тетрил можно получить двустадийным нитрованием монометиланилина азотной кислотой. На первой стадии монометиланилин нитруется 50-60% азотной кислотой до динитрометиланилина, а на второй до тетрила.
Применение
Впервые был получен в 1877 г. Начал использоваться в качестве вторичного заряда в капсюлях-детонаторах и прочих средств подрыва с 1906 г в Германии. В России и Англии – с 1910 г. Во время 2-й мировой войны, кроме средств подрыва, использовался также в смесевых ВВ для снаряжения боеприпасов, напр., в малокалиберных снарядах в смеси с флегматизатором и в сплавах с тротилом (т. н. тетритолы, которые использовались в индивидуальном виде и в виде плавкой основы для литьевых смесей с гексогеном. Тетритолы с высоким содержанием тетрила по эффективности в кумулятивных боеприпасах эквивалентны пентолиту 50/50). В настоящее время тетрил имеет второстепенное значение и в большинстве стран снят с промышленного производства (напр., в США), вместо него используют более мощные ТЭН (Пентаэритриттетранитрат) и особенно гексоген.
Ссылки
- http://chemistry-chemists.com/N2_2013/P1/pirosprawka2012.pdf
- http://pirochem.net/index.php?id1=3&category=azgotov-prim-vv&author=shtetbaher-a&book=1936
- https://exploders.info/sprawka/63.html Архивная копия от 11 ноября 2016 на Wayback Machine
- http://pirochem.net/index.php?id1=3&category=chemvvisost&author=hmelnickiy-li&book=19622 Архивная копия от 12 июля 2017 на Wayback Machine
Примечания
Литература
- Зефиров Н.С. и др. т.4 Пол-Три // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1995. — 639 с. — 20 000 экз. — ISBN 5-85270-092-4.
- Волков И. Подрывные средства при устройстве заграждений. — Москва: Государственное военное издательство, 1933.