Система токсин-антитоксин
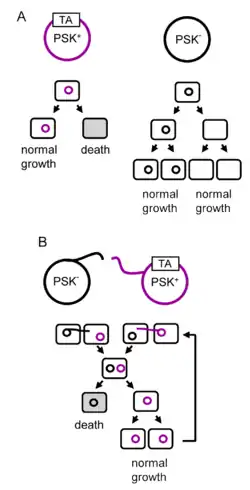
Систе́ма токси́н-антитокси́н (англ. toxin-antitoxin system) — набор двух и более тесно связанных генов, которые в совокупности кодируют и белок-«яд», и соответствующее ему «противоядие». Когда такая система локализована на плазмиде (автономном генетическом элементе), то в результате деления исходной клетки, содержащей плазмиду, дочерняя клетка выживет только в том случае, если унаследует плазмиду. Если дочерняя клетка лишена плазмиды, то нестабильный антитоксин, унаследованный с цитоплазмой матери, разрушается, а стабильный токсичный белок убивает клетку; это явление получило название «постсегрегационное убийство» (англ. post-segregational killing, PSK)[2][3]. Системы токсин-антитоксин широко распространены среди прокариот, и зачастую один прокариотический организм содержит множество копий таких систем[4][5].
Системы токсин-антитоксин обычно классифицируют по тому, как антитоксин нейтрализует токсин. В случае систем токсин-антитоксин I типа трансляция мРНК, кодирующей токсин, подавляется при связывании с ней малой некодирующей РНК, служащей антитоксином. В случае систем II типа белок-токсин ингибируется посттрансляционно путём связывания с другим белком — антитоксином. Известен один пример систем III типа, в которых белок-токсин непосредственно связывается с РНК-антитоксином[6]. Гены, кодирующие токсин-антитоксин, часто передаются от организма к организму путём горизонтального переноса генов[7]. Нередко они ассоциированы с патогенными бактериями и нередко локализуются на плазмидах, несущих гены вирулентности и устойчивости к антибиотикам[1].
Существуют и хромосомные системы токсин-антитоксин, некоторые из них участвуют в таких клеточных процессах, как ответ на стресс, остановка клеточного цикла и программируемая клеточная смерть[1][8]. С точки зрения эволюции системы токсин-антитоксин могут рассматриваться как эгоистичная ДНК, то есть целью этих систем является увеличение собственной численности вне зависимости от того, принесут они организму-хозяину пользу или вред. Были предложены адаптивные теории, объясняющие эволюцию систем токсин-антитоксин; например, возможно, что хромосомные системы токсин-антитоксин появились для того, чтобы предотвращать наследование крупных делеций в хозяйском геноме[9]. Системы токсин-антитоксин нашли применение в биотехнологии, например, в методе поддержания плазмид в клеточных линиях. Они могут служить мишенями антибиотиков и использоваться как векторы для положительного отбора[10].
Эволюционные преимущества
Плазмиды, содержащие системы токсин-антитоксин, рассматриваются как пример эгоистичной ДНК в рамках геноцентрического взгляда на эволюцию (англ. Gene-centered view of evolution). Считается, что системы токсин-антитоксин могут только поддерживать собственную ДНК, даже в ущерб организму-хозяину[1]. Согласно другим теориям, эти системы повышают приспособленность несущих их плазмид по сравнению с обычными плазмидами[11]. В этом случае системы токсин-антитоксин помогают хозяйской ДНК, избавляя потомство клетки от других плазмид (система токсин-антитоксин, локализованная на плазмиде, приводит к гибели клеток, не унаследовавших при делении этой плазмиды, поэтому, если клетка погибает, то и содержащиеся в ней плазмиды элиминируются). Это представление подкрепляется данными компьютерного моделирования[12]. Впрочем, оно не объясняет присутствие систем токсин-антитоксин на хромосомах.
Существует ряд адаптивных теорий, объясняющих эволюционное преимущество хромосомных систем токсин-антитоксин перед естественным отбором. Простейшее объяснение существования таких систем на хромосомах заключается в том, что они предотвращают появление опасных крупных делеций в геноме клетки[9]. Токсин-антитоксиновый локус MazEF Escherichia coli и других бактерий индуцирует программируемую гибель клетки в ответ на длительное голодание, особенно на отсутствие аминокислот[15]. Содержимое погибшей клетки абсорбируется соседними клетками, то есть, возможно, предотвращает смерть близких родственников погибшей клетки и тем самым увеличивает совокупную приспособленность погибшей клетки. Такой пример альтруизма сближает бактериальные колонии с многоклеточными организмами[12].
Согласно другой теории, хромосомные системы токсин-антитоксин являются бактериостатическими, но не бактерицидными[16]. Например, RelE глобально ингибирует трансляцию в условиях нехватки питательных веществ, и его экспрессия снижает риск голодания, уменьшая потребности клетки в питательных веществах[17]. Гомолог токсина mazF, mazF-mx, необходим для образования плодовых тел у Myxococcus xanthus[18]. Эти бактерии образуют густые скопления, и при недостатке питательных веществ группа из 50000 клеток собирается в плодовое тело[19]. Токсин maxF-mx является компонентом пути ответа на стресс, обусловленный недостатком питательных веществ, и даёт возможность некоторым клеткам плодового тела образовать миксоспоры. Было высказано предположение, что M. xanthus «поработил» систему токсин-антитоксин и взял антитоксин под собственный молекулярный контроль для регуляции своего жизненного цикла[18].
Было высказано предположение, что хромосомные копии систем токсин-антитоксин могут обеспечивать противопривыкание, то есть помогают исключить плазмиду из потомства клетки, не подвергая её воздействию токсина. Например, в геноме Erwinia chrysanthemi закодирован антитоксин, который противодействует токсину, кодируемому F-плазмидой[20].
Было предложено девять возможных функций систем токсин-антитоксин[21]:
- Клеточный «мусор»: системы токсин-антитоксин были заимствованы от плазмид и оставлены в клетках из-за развившегося привыкания к их токсинам.
- Стабилизация геномных паразитов (остатков от транспозонов и бактериофагов). Наличие систем токсин-антитоксин на этих элементах может приносить им выгоду, снижая возможность их делеций. Многие хромосомные системы токсин-антитоксин при ближайшем рассмотрении могут в действительности принадлежать встроенным в геном паразитическим элементам или их остаткам.
- Эгоистичные аллели: в ходе рекомбинации аллели, не вызывающие привыкания, не могут заместить аллели, вызывающие привыкание, однако противоположная замена возможна.
- Регуляция генов: некоторые токсины действуют как общие репрессоры экспрессии генов[22], в то время как другие более специфичны[23].
- Контроль роста: как отмечалось, бактериостатические токсины не убивают клетку-хозяина, а ограничивают её рост[16].
- Устойчивые клетки: в некоторых популяциях бактерий имеется субпопуляция клеток, обладающая устойчивостью ко множеству антибиотиков, контролируемой системами токсин-антитоксин. Эти медленнорастущие выносливые клетки страхуют популяцию от полного вымирания[24].
- Программируемая гибель клетки и выживание её близких родственников, как в описанном выше примере альтруизма, обусловленного MazEF (см. выше).
- Различный уровень устойчивости клеток популяции к стрессовым условиям, обусловливающий программируемую гибель некоторых клеток, которая предотвращает вымирание всей популяции.
- Противодействие бактериофагам: когда бактериофаг нарушает транскрипцию и трансляцию клеточных белков, активация систем токсин-антитоксин ограничивает репликацию фага[25][26].
Впрочем, эксперимент, в котором из клеток штамма E. coli были удалены пять систем токсин-антитоксин, не дал никаких доказательств в пользу существования преимуществ, которые системы токсин-антитоксин дают клетке-хозяину. Эти результаты заставляют усомниться в гипотезах контроля роста и программируемой клеточной гибели[27].
Классификация
Тип I
Действие систем токсин-антитоксин I типа обусловлено комплементарным спариванием оснований РНК-антитоксина с мРНК, кодирующей белок-токсин. Трансляция этой мРНК подавляется или из-за разрушения РНКазой III, или из-за уменьшения доступности последовательности Шайна — Дальгарно или сайта связывания рибосомы. В этих случаях токсин и антитоксин нередко кодируются противоположными цепями ДНК. Перекрывающийся участок этих двух генов (обычно его длина составляет 19—23 нуклеотида) обусловливает их комплементарное спаривание[28].
Токсины в системах I типа представлены небольшими гидрофобными белками, токсичность которых обусловлена их способностью разрушать мембраны клетки[1]. Лишь для немногих токсинов систем I типа были определены внутриклеточные мишени, возможно, из-за сложностей, связанных с изучением белков, токсичных для содержащих их клеток[8].
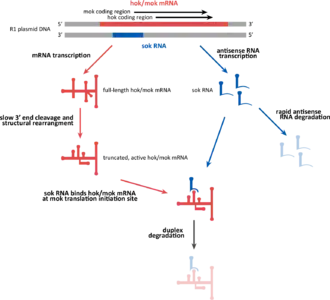
Иногда системы I типа включают и третий компонент. В случае хорошо изученной системы hok/sok, кроме токсина hok и антитоксина sok, имеется третий ген, названный mok. Он практически целиком перекрывается с геном, кодирующим токсин, и трансляция токсина зависит от трансляции этого третьего компонента[3]. По этой причине представление о связывании токсина с антитоксином в некоторых случаях является упрощением, и антитоксин на самом деле связывается с третьей РНК, которая уже потом действует на трансляцию токсина[28].
Примеры систем
| Токсин | Антитоксин | Комментарий | Источник |
|---|---|---|---|
| Hok | Sok | Первая известная и наиболее хорошо изученная система I типа, которая стабилизирует плазмиды у ряда грамотрицательных бактерий | [28] |
| fst | RNAII | Первая система I типа, идентифицированная у грамположительной бактерии, обнаружена у энтерококка | [29] |
| TisB | IstR | Отвечает на повреждения ДНК | [30] |
| LdrD | RdlD | Хромосомная система, обнаружена у энтеробактерий | [31] |
| FlmA | FlmB | Гомолог hok/sok, который также стабилизирует F-плазмиду | [32] |
| Ibs | Sib | Изначально был назван QUAD-РНК. Открыт в межгенных участках E. coli | [33] |
| TxpA/BrnT | RatA | Обеспечивает наследованиеskin-элемента при споруляции уBacillus subtilis | [34] |
| SymE | SymR | Хромосомная система, индуцируемая при SOS-ответе | [5] |
| XCV2162 | ptaRNA1 | Идентифицирована у Xanthomonas campestris и встречается у филогенетически разнородных организмов. | [35] |
Тип II
Системы типа II изучены лучше систем типа I[28]. В этих системах неустойчивый белок-антитоксин прочно связывается со стабильным токсином и подавляет его активность[8]. Крупнейшее семейство систем этого типа — vapBC[36], и методами биоинформатики было установлено, что от 37 до 42 % систем II типа относятся к этому семейству[13][14].
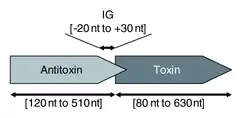
Системы типа II, как правило, организованы в опероны, причём ген, кодирующий антитоксин, обычно располагается выше гена, кодирующего токсин. Антитоксин подавляет токсин, отрицательно регулируя его экспрессию. Токсин и антитоксин, как правило, имеют длину около 100 аминокислотных остатков[28]. Вредоносность токсина может быть обусловлена несколькими свойствами. Белок CcdB, например, нарушает работу ДНК-топоизомераз II и ДНК-гиразы[37], а белок MazF является опасной эндорибонуклеазой, которая разрезает клеточные мРНК по специфическим мотивам[38]. Наиболее часто токсины являются эндонуклеазами, которые также известны как интерферазы[39][40].
Иногда в системах токсин-антитоксин II типа появляется третий белок[41]. В случае вышеупомянутой системы MazEF имеется дополнительный регуляторный белок — MazG. Он взаимодействует с ГТФазой Era E. coli и характеризуется как нуклеозидтрифосфатпирофосфатгидролаза[42], которая гидролизует нуклеозидтрифосфаты до монофосфатов. Дальнейшие исследования показали, что MazG транскрибируется в ту же полицистронную РНК, что и MazE и MazF, и MazG связывается с токсином MazF, дополнительно ингибируя его активность[43].
Примеры систем
| Токсин | Антитоксин | Комментарий | Источник |
|---|---|---|---|
| CcdB | CcdA | Располагается в F-плазмиде E. coli | [37] |
| ParE | ParD | Имеется во множестве копий у Caulobacter crescentus | [44] |
| MazF | MazE | Встречается на хромосоме E. coli и других бактерий | [25] |
| yafO | yafN | Система индуцируется SOS-ответом на повреждение ДНК у E. coli | [41] |
| HicA | HicB | Обнаружена у архей и бактерий | [45] |
| Kid | Kis | Стабилизирует плазмиду R1; родственна системе CcdB/A | [16] |
Тип III
| Токсин ToxN | |
|---|---|
| Идентификаторы | |
| Символ | ToxN, тип III систем токсин-антитоксин |
| Pfam | PF13958 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Системы токсин-антитоксин III типа полагаются на непосредственное взаимодействие белка-токсина и РНК-антитоксина. Токсичные эффекты белка нейтрализуются непосредственно РНК[6]. Единственным известным на данный момент примером является система ToxIN, найденная у патогенной для растений бактерии Pectobacterium carotovorum. Белок-токсин ToxN имеет длину около 170 аминокислотных остатков и токсичен для E. coli. Его ядовитость подавляется РНК ToxI, которая содержит 5,5 тандемных повторов мотива из 36 нуклеотидов (AGGTGATTTGCTACCTTTAAGTGCAGCTAGAAATTC)[46][47]. Кристаллографический анализ ToxIN показал, что для ингибирования ToxN необходимо образование тримерного комплекса ToxIN, в котором три мономера связаны с тремя мономерами ToxN. Комплекс удерживается за счёт множественных РНК-белковых взаимодействий[48].
Биотехнологическое применение
Биотехнологическое применение систем токсин-антитоксин начали несколько биотехнологических компаний[10][16]. Системы токсин-антитоксин используются в основном для поддержания плазмид в больших культурах клеток бактерий. В эксперименте, проверяющем эффективность локуса hok/sok, было показано, что вставленная плазмида, экспрессирующая бета-галактозидазу, сохраняла в 8—22 раза большую стабильность при клеточных делениях, чем в контрольной культуре, лишённой системы токсин-антитоксин[49][50]. В широко использующихся микробиологических процессах, например, брожении, те дочерние клетки, которые не унаследовали плазмиду, имеют большую приспособленность по сравнению с клетками, содержащими плазмиды, и в конце концов лишённые плазмид клетки могут полностью вытеснить ценные промышленные микроорганизмы. Таким образом, системы токсин-антитоксин, помогающие поддерживать важные плазмиды, способствуют поддержанию эффективности промышленных процессов[10].
Кроме того, системы токсин-антитоксин в будущем могут стать мишенями антибиотиков. Индукция молекул, губительных для патогенов, может помочь преодолеть всё возрастающую проблему множественной лекарственной устойчивости[51].
Отбор плазмид, содержащих вставку, является широко распространённой проблемой при клонировании ДНК. Системы токсин-антитоксин могут использоваться для положительного отбора лишь тех клеток, которые содержат плазмиду с интересующей исследователя вставкой, отбрасывая те клетки, которые не содержат вставленного гена. Например, в плазмидные векторы вставляют ген CcdB, кодирующий токсин[52]. Интересующий ген затем вступает в рекомбинацию с геном CcdB, инактивируя транскрипцию токсичного белка. Поэтому трансформированные клетки, содержащие плазмиду, но не вставку, погибают из-за токсичных свойств белка CcdB, и выживают только те клетки, которые имеют плазмиду со вставкой[10].
Возможно использование также и токсина CcdB, и антитоксина CcdA. CcdB находится в рекомбинатном геноме бактерии, а инактивированная версия CcdA вставляется в линейный плазмидный вектор. К интересующему гену пришивается короткая последовательность, которая активирует ген антитоксина при его вставке в это место. С помощью этого метода можно получить направленно-специфичную вставку гена[52].
Примечания
- Van Melderen L., Saavedra De Bast M. Bacterial toxin-antitoxin systems: more than selfish entities? (англ.) // PLoS genetics. — 2009. — Vol. 5, no. 3. — P. e1000437. — doi:10.1371/journal.pgen.1000437. — PMID 19325885.
- Gerdes K. Toxin-antitoxin modules may regulate synthesis of macromolecules during nutritional stress. (англ.) // Journal of bacteriology. — 2000. — Vol. 182, no. 3. — P. 561—572. — PMID 10633087.
- Faridani O. R., Nikravesh A., Pandey D. P., Gerdes K., Good L. Competitive inhibition of natural antisense Sok-RNA interactions activates Hok-mediated cell killing in Escherichia coli. (англ.) // Nucleic acids research. — 2006. — Vol. 34, no. 20. — P. 5915—5922. — doi:10.1093/nar/gkl750. — PMID 17065468.
- Fozo E. M., Makarova K. S., Shabalina S. A., Yutin N., Koonin E. V., Storz G. Abundance of type I toxin-antitoxin systems in bacteria: searches for new candidates and discovery of novel families. (англ.) // Nucleic acids research. — 2010. — Vol. 38, no. 11. — P. 3743—3759. — doi:10.1093/nar/gkq054. — PMID 20156992.
- Gerdes K., Wagner E. G. RNA antitoxins. (англ.) // Current opinion in microbiology. — 2007. — Vol. 10, no. 2. — P. 117—124. — doi:10.1016/j.mib.2007.03.003. — PMID 17376733.
- Labrie S. J., Samson J. E., Moineau S. Bacteriophage resistance mechanisms. (англ.) // Nature reviews. Microbiology. — 2010. — Vol. 8, no. 5. — P. 317—327. — doi:10.1038/nrmicro2315. — PMID 20348932.
- Mine N., Guglielmini J., Wilbaux M., Van Melderen L. The decay of the chromosomally encoded ccdO157 toxin-antitoxin system in the Escherichia coli species. (англ.) // Genetics. — 2009. — Vol. 181, no. 4. — P. 1557—1566. — doi:10.1534/genetics.108.095190. — PMID 19189956.
- Hayes F. Toxins-antitoxins: plasmid maintenance, programmed cell death, and cell cycle arrest. (англ.) // Science (New York, N.Y.). — 2003. — Vol. 301, no. 5639. — P. 1496—1499. — doi:10.1126/science.1088157. — PMID 12970556.
- Rowe-Magnus D. A., Guerout A. M., Biskri L., Bouige P., Mazel D. Comparative analysis of superintegrons: engineering extensive genetic diversity in the Vibrionaceae. (англ.) // Genome research. — 2003. — Vol. 13, no. 3. — P. 428—442. — doi:10.1101/gr.617103. — PMID 12618374.
- Stieber D., Gabant P., Szpirer C. The art of selective killing: plasmid toxin/antitoxin systems and their technological applications. (англ.) // BioTechniques. — 2008. — Vol. 45, no. 3. — P. 344—346. — doi:10.2144/000112955. — PMID 18778262.
- Cooper T. F., Heinemann J. A. Postsegregational killing does not increase plasmid stability but acts to mediate the exclusion of competing plasmids. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2000. — Vol. 97, no. 23. — P. 12643—12648. — doi:10.1073/pnas.220077897. — PMID 11058151.
- Mochizuki A., Yahara K., Kobayashi I., Iwasa Y. Genetic addiction: selfish gene's strategy for symbiosis in the genome. (англ.) // Genetics. — 2006. — Vol. 172, no. 2. — P. 1309—1323. — doi:10.1534/genetics.105.042895. — PMID 16299387.
- Pandey D. P., Gerdes K. Toxin-antitoxin loci are highly abundant in free-living but lost from host-associated prokaryotes. (англ.) // Nucleic acids research. — 2005. — Vol. 33, no. 3. — P. 966—976. — doi:10.1093/nar/gki201. — PMID 15718296.
- Sevin E. W., Barloy-Hubler F. RASTA-Bacteria: a web-based tool for identifying toxin-antitoxin loci in prokaryotes. (англ.) // Genome biology. — 2007. — Vol. 8, no. 8. — P. 155. — doi:10.1186/gb-2007-8-8-r155. — PMID 17678530.
- Aizenman E., Engelberg-Kulka H., Glaser G. An Escherichia coli chromosomal "addiction module" regulated by guanosine [corrected 3',5'-bispyrophosphate: a model for programmed bacterial cell death.] (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1996. — Vol. 93, no. 12. — P. 6059—6063. — PMID 8650219.
- Diago-Navarro E., Hernandez-Arriaga A. M., López-Villarejo J., Muñoz-Gómez A. J., Kamphuis M. B., Boelens R., Lemonnier M., Díaz-Orejas R. parD toxin-antitoxin system of plasmid R1--basic contributions, biotechnological applications and relationships with closely-related toxin-antitoxin systems. (англ.) // The FEBS journal. — 2010. — Vol. 277, no. 15. — P. 3097—3117. — doi:10.1111/j.1742-4658.2010.07722.x. — PMID 20569269.
- Christensen S. K., Mikkelsen M., Pedersen K., Gerdes K. RelE, a global inhibitor of translation, is activated during nutritional stress. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2001. — Vol. 98, no. 25. — P. 14328—14333. — doi:10.1073/pnas.251327898. — PMID 11717402.
- Nariya H., Inouye M. MazF, an mRNA interferase, mediates programmed cell death during multicellular Myxococcus development. (англ.) // Cell. — 2008. — Vol. 132, no. 1. — P. 55—66. — doi:10.1016/j.cell.2007.11.044. — PMID 18191220.
- Curtis P. D., Taylor R. G., Welch R. D., Shimkets L. J. Spatial organization of Myxococcus xanthus during fruiting body formation. (англ.) // Journal of bacteriology. — 2007. — Vol. 189, no. 24. — P. 9126—9130. — doi:10.1128/JB.01008-07. — PMID 17921303.
- Saavedra De Bast M., Mine N., Van Melderen L. Chromosomal toxin-antitoxin systems may act as antiaddiction modules. (англ.) // Journal of bacteriology. — 2008. — Vol. 190, no. 13. — P. 4603—4609. — doi:10.1128/JB.00357-08. — PMID 18441063.
- Magnuson R. D. Hypothetical functions of toxin-antitoxin systems. (англ.) // Journal of bacteriology. — 2007. — Vol. 189, no. 17. — P. 6089—6092. — doi:10.1128/JB.00958-07. — PMID 17616596.
- Engelberg-Kulka H., Amitai S., Kolodkin-Gal I., Hazan R. Bacterial programmed cell death and multicellular behavior in bacteria. (англ.) // PLoS genetics. — 2006. — Vol. 2, no. 10. — P. e135. — doi:10.1371/journal.pgen.0020135. — PMID 17069462.
- Pimentel B., Madine M. A., de la Cueva-Méndez G. Kid cleaves specific mRNAs at UUACU sites to rescue the copy number of plasmid R1. (англ.) // The EMBO journal. — 2005. — Vol. 24, no. 19. — P. 3459—3469. — doi:10.1038/sj.emboj.7600815. — PMID 16163387.
- Kussell E., Kishony R., Balaban N. Q., Leibler S. Bacterial persistence: a model of survival in changing environments. (англ.) // Genetics. — 2005. — Vol. 169, no. 4. — P. 1807—1814. — doi:10.1534/genetics.104.035352. — PMID 15687275.
- Hazan R., Engelberg-Kulka H. Escherichia coli mazEF-mediated cell death as a defense mechanism that inhibits the spread of phage P1. (англ.) // Molecular genetics and genomics : MGG. — 2004. — Vol. 272, no. 2. — P. 227—234. — doi:10.1007/s00438-004-1048-y. — PMID 15316771.
- Pecota D. C., Wood T. K. Exclusion of T4 phage by the hok/sok killer locus from plasmid R1. (англ.) // Journal of bacteriology. — 1996. — Vol. 178, no. 7. — P. 2044—2050. — PMID 8606182.
- Tsilibaris V., Maenhaut-Michel G., Mine N., Van Melderen L. What is the benefit to Escherichia coli of having multiple toxin-antitoxin systems in its genome? (англ.) // Journal of bacteriology. — 2007. — Vol. 189, no. 17. — P. 6101—6108. — doi:10.1128/JB.00527-07. — PMID 17513477.
- Fozo E. M., Hemm M. R., Storz G. Small toxic proteins and the antisense RNAs that repress them. (англ.) // Microbiology and molecular biology reviews : MMBR. — 2008. — Vol. 72, no. 4. — P. 579—589. — doi:10.1128/MMBR.00025-08. — PMID 19052321.
- Greenfield T. J., Ehli E., Kirshenmann T., Franch T., Gerdes K., Weaver K. E. The antisense RNA of the par locus of pAD1 regulates the expression of a 33-amino-acid toxic peptide by an unusual mechanism. (англ.) // Molecular microbiology. — 2000. — Vol. 37, no. 3. — P. 652—660. — PMID 10931358.
- Vogel J., Argaman L., Wagner E. G., Altuvia S. The small RNA IstR inhibits synthesis of an SOS-induced toxic peptide. (англ.) // Current biology : CB. — 2004. — Vol. 14, no. 24. — P. 2271—2276. — doi:10.1016/j.cub.2004.12.003. — PMID 15620655.
- Kawano M., Oshima T., Kasai H., Mori H. Molecular characterization of long direct repeat (LDR) sequences expressing a stable mRNA encoding for a 35-amino-acid cell-killing peptide and a cis-encoded small antisense RNA in Escherichia coli. (англ.) // Molecular microbiology. — 2002. — Vol. 45, no. 2. — P. 333—349. — PMID 12123448.
- Loh S. M., Cram D. S., Skurray R. A. Nucleotide sequence and transcriptional analysis of a third function (Flm) involved in F-plasmid maintenance. (англ.) // Gene. — 1988. — Vol. 66, no. 2. — P. 259—268. — PMID 3049248.
- Fozo E. M., Kawano M., Fontaine F., Kaya Y., Mendieta K. S., Jones K. L., Ocampo A., Rudd K. E., Storz G. Repression of small toxic protein synthesis by the Sib and OhsC small RNAs. (англ.) // Molecular microbiology. — 2008. — Vol. 70, no. 5. — P. 1076—1093. — doi:10.1111/j.1365-2958.2008.06394.x. — PMID 18710431.
- Silvaggi J. M., Perkins J. B., Losick R. Small untranslated RNA antitoxin in Bacillus subtilis. (англ.) // Journal of bacteriology. — 2005. — Vol. 187, no. 19. — P. 6641—6650. — doi:10.1128/JB.187.19.6641-6650.2005. — PMID 16166525.
- Findeiss S., Schmidtke C., Stadler P. F., Bonas U. A novel family of plasmid-transferred anti-sense ncRNAs. (англ.) // RNA biology. — 2010. — Vol. 7, no. 2. — P. 120—124. — PMID 20220307.
- Robson J., McKenzie J. L., Cursons R., Cook G. M., Arcus V. L. The vapBC operon from Mycobacterium smegmatis is an autoregulated toxin-antitoxin module that controls growth via inhibition of translation. (англ.) // Journal of molecular biology. — 2009. — Vol. 390, no. 3. — P. 353—367. — doi:10.1016/j.jmb.2009.05.006. — PMID 19445953.
- Bernard P., Couturier M. Cell killing by the F plasmid CcdB protein involves poisoning of DNA-topoisomerase II complexes. (англ.) // Journal of molecular biology. — 1992. — Vol. 226, no. 3. — P. 735—745. — PMID 1324324.
- Zhang Y., Zhang J., Hoeflich K. P., Ikura M., Qing G., Inouye M. MazF cleaves cellular mRNAs specifically at ACA to block protein synthesis in Escherichia coli. (англ.) // Molecular cell. — 2003. — Vol. 12, no. 4. — P. 913—923. — PMID 14580342.
- Christensen-Dalsgaard M., Overgaard M., Winther K. S., Gerdes K. RNA decay by messenger RNA interferases. (англ.) // Methods in enzymology. — 2008. — Vol. 447. — P. 521—535. — doi:10.1016/S0076-6879(08)02225-8. — PMID 19161859.
- Yamaguchi Y., Inouye M. mRNA interferases, sequence-specific endoribonucleases from the toxin-antitoxin systems. (англ.) // Progress in molecular biology and translational science. — 2009. — Vol. 85. — P. 467—500. — doi:10.1016/S0079-6603(08)00812-X. — PMID 19215780.
- Singletary L. A., Gibson J. L., Tanner E. J., McKenzie G. J., Lee P. L., Gonzalez C., Rosenberg S. M. An SOS-regulated type 2 toxin-antitoxin system. (англ.) // Journal of bacteriology. — 2009. — Vol. 191, no. 24. — P. 7456—7465. — doi:10.1128/JB.00963-09. — PMID 19837801.
- Zhang J., Inouye M. MazG, a nucleoside triphosphate pyrophosphohydrolase, interacts with Era, an essential GTPase in Escherichia coli. (англ.) // Journal of bacteriology. — 2002. — Vol. 184, no. 19. — P. 5323—5329. — PMID 12218018.
- Gross M., Marianovsky I., Glaser G. MazG -- a regulator of programmed cell death in Escherichia coli. (англ.) // Molecular microbiology. — 2006. — Vol. 59, no. 2. — P. 590—601. — doi:10.1111/j.1365-2958.2005.04956.x. — PMID 16390452.
- Fiebig A., Castro Rojas C. M., Siegal-Gaskins D., Crosson S. Interaction specificity, toxicity and regulation of a paralogous set of ParE/RelE-family toxin-antitoxin systems. (англ.) // Molecular microbiology. — 2010. — Vol. 77, no. 1. — P. 236—251. — doi:10.1111/j.1365-2958.2010.07207.x. — PMID 20487277.
- Jørgensen M. G., Pandey D. P., Jaskolska M., Gerdes K. HicA of Escherichia coli defines a novel family of translation-independent mRNA interferases in bacteria and archaea. (англ.) // Journal of bacteriology. — 2009. — Vol. 191, no. 4. — P. 1191—1199. — doi:10.1128/JB.01013-08. — PMID 19060138.
- Fineran P. C., Blower T. R., Foulds I. J., Humphreys D. P., Lilley K. S., Salmond G. P. The phage abortive infection system, ToxIN, functions as a protein-RNA toxin-antitoxin pair. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2009. — Vol. 106, no. 3. — P. 894—899. — doi:10.1073/pnas.0808832106. — PMID 19124776.
- Blower T. R., Fineran P. C., Johnson M. J., Toth I. K., Humphreys D. P., Salmond G. P. Mutagenesis and functional characterization of the RNA and protein components of the toxIN abortive infection and toxin-antitoxin locus of Erwinia. (англ.) // Journal of bacteriology. — 2009. — Vol. 191, no. 19. — P. 6029—6039. — doi:10.1128/JB.00720-09. — PMID 19633081.
- Blower T. R., Pei X. Y., Short F. L., Fineran P. C., Humphreys D. P., Luisi B. F., Salmond G. P. A processed noncoding RNA regulates an altruistic bacterial antiviral system. (англ.) // Nature structural & molecular biology. — 2011. — Vol. 18, no. 2. — P. 185—190. — doi:10.1038/nsmb.1981. — PMID 21240270.
- Wu K., Jahng D., Wood T. K. Temperature and growth rate effects on the hok/sok killer locus for enhanced plasmid stability. (англ.) // Biotechnology progress. — 1994. — Vol. 10, no. 6. — P. 621—629. — doi:10.1021/bp00030a600. — PMID 7765697.
- Pecota D. C., Kim C. S., Wu K., Gerdes K., Wood T. K. Combining the hok/sok, parDE, and pnd postsegregational killer loci to enhance plasmid stability. (англ.) // Applied and environmental microbiology. — 1997. — Vol. 63, no. 5. — P. 1917—1924. — PMID 9143123.
- Gerdes K., Christensen S. K., Løbner-Olesen A. Prokaryotic toxin-antitoxin stress response loci. (англ.) // Nature reviews. Microbiology. — 2005. — Vol. 3, no. 5. — P. 371—382. — doi:10.1038/nrmicro1147. — PMID 15864262.
- Bernard P., Gabant P., Bahassi E. M., Couturier M. Positive-selection vectors using the F plasmid ccdB killer gene. (англ.) // Gene. — 1994. — Vol. 148, no. 1. — P. 71—74. — PMID 7926841.
Литература
- Wen J., Won D., Fozo E. M. The ZorO-OrzO type I toxin-antitoxin locus: repression by the OrzO antitoxin. (англ.) // Nucleic acids research. — 2014. — Vol. 42, no. 3. — P. 1930—1946. — doi:10.1093/nar/gkt1018. — PMID 24203704.
Ссылки
- База данных систем токсин-антитоксин.
- RASTA Rapid Automated Scan for Toxins and Antitoxins in Bacteria (недоступная ссылка). Дата обращения: 25 июля 2015. Архивировано 3 марта 2016 года.