Серин-С-пальмитоилтрансфераза
Серин-С-пальмитоилтрансфераза, также серин-пальмитоилтрансфераза, 3-оксосфинганин синтаза (serine C-palmitoyltransferase, сокр. SPT, КФ 2.3.1.50) — фермент из семейства ацилтрансфераз (тип трансфераз), катализирующий реакцию переноса ацильной группы на молекулу субстрата — серина, по уравнению[1][2]:
- пальмитоил-CoA + серин CoA-SH + 3-дегидро-D-сфинганин + CO2.
| Серин-С-пальмитоилтрансфераза | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 2.3.1.50 |
| Номер CAS | 62213-50-7 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 62213-50-7 |
В реакции участвуют два субстрата серин и пальмитоил-CoA, продуктами реакции являются кофермент А, 3-дегидро-D-сфинганин и углекислый газ[3][4]. Реакция является ключевой ступенью в биосинтезе сфингозина, который является предшественником многих сфинголипидов. В качестве кофактора фермент использует пиридоксальфосфат (PLP).
Структура
Серин C-пальмитоилтрансфераза является членом семейства AOS (a-оксоаминсинтазы) PLP-зависимых ферментов, которые катализируют конденсацию аминокислот и ацил-CoA-тиоэфирных субстратов[5]. Человеческий фермент представляет собой гетеродимер, состоящий из двух мономерных субъединиц, известных как длинная цепь 1 и 2 (LCB1/2), кодируемых отдельными генами. Активный сайт LCB2 содержит лизин и другие ключевые каталитические аминокислотные остатки, которые отсутствуют в LCB1, ине участвует в катализе, но тем не менее необходимы для синтеза и стабильности фермента[6].
По состоянию на конец 2007 года были изучены две структуры для этого класса ферментов, с кодами доступа PDB 2JG2 и 2JGT[7].
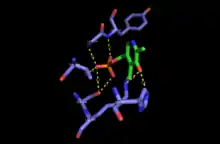
Механизм
PLP (пиридоксаль-5'-фосфат)-зависимая серин-C-пальмитоилтрансфераза выполняет первую ферментативную стадию биосинтеза de novo сфинголипидов. Фермент катализирует кляйзен-подобную конденсацию между L-серином и субстратом ацил-CoA-тиоэфиром (CoASH) (как правило, ацил — C16-пальмитоил) или ацил-ACP (ацил-ацилпереносящий белок) тиоэфирным субстратом с образованием 3-кетодигидрофингозина. Первоначально кофактор PLP связывается с лизином активного сайта посредстом основания Шиффа, чтобы образовать голо-форму или внутренний альдимин фермента. Затем аминогруппа L-серина атакует и вытесняет лизин, связанный с PLP, образуя внешнее альдиминовое промежуточное соединение. Затем происходит депротонирование на α-С-атоме серина, образуя хиноноидное промежуточное соединение, которое атакует входящий тиоэфирный субстрат. После декарбоксилирования и атаки лизина, продукт реакции 3-кетодигидрофингозин высвобождается и каталитически активный PLP реформируется. Эта реакция конденсации образует основание сфингоидов или основание с длинной цепью, обнаруженное во всех последующих промежуточных сфинголипидах и сложных сфинголипидах в организме[2].
Примечания
- Ikushiro H., Hayashi H., Kagamiyama H. Bacterial serine palmitoyltransferase: a water-soluble homodimeric prototype of the eukaryotic enzyme (англ.) // Biochimica et Biophysica Acta : journal. — 2003. — April (vol. 1647, no. 1—2). — P. 116—120. — doi:10.1016/S1570-9639(03)00074-8. — PMID 12686119.
- Hanada K. Serine palmitoyltransferase, a key enzyme of sphingolipid metabolism (англ.) // Biochimica et Biophysica Acta : journal. — 2003. — June (vol. 1632, no. 1—3). — P. 16—30. — doi:10.1016/S1388-1981(03)00059-3. — PMID 12782147.
- Brady R.N., Di Mari S.J., Snell E.E. Biosynthesis of sphingolipid bases. 3. Isolation and characterization of ketonic intermediates in the synthesis of sphingosine and dihydrosphingosine by cell-free extracts of Hansenula ciferri (англ.) // J. Biol. Chem. : journal. — 1969. — January (vol. 244, no. 2). — P. 491—496. — PMID 4388074.
- Stoffel W., LeKim D., Sticht G. Biosynthesis of dihydrosphingosine in vitro (англ.) // Hoppe-Seyler's Z. Physiol. Chem. : journal. — 1968. — May (vol. 349, no. 5). — P. 664—670. — doi:10.1515/bchm2.1968.349.1.664. — PMID 4386961.
- Eliot A.C., Kirsch J.F. Pyridoxal phosphate enzymes: mechanistic, structural, and evolutionary considerations (англ.) // Annual Review of Biochemistry : journal. — 2004. — Vol. 73. — P. 383—415. — doi:10.1146/annurev.biochem.73.011303.074021. — PMID 15189147.
- Han G., Gable K., Yan L., Natarajan M., Krishnamurthy J., Gupta S.D., Borovitskaya A., Harmon J.M., Dunn T.M. The topology of the Lcb1p subunit of yeast serine palmitoyltransferase (англ.) // The Journal of Biological Chemistry : journal. — 2004. — December (vol. 279, no. 51). — P. 53707—53716. — doi:10.1074/jbc.M410014200. — PMID 15485854.
- Yard B.A., Carter L.G., Johnson K.A., Overton I.M., Dorward M., Liu H., McMahon S.A., Oke M., Puech D., Barton G.J., Naismith J.H., Campopiano D.J. The structure of serine palmitoyltransferase; gateway to sphingolipid biosynthesis (англ.) // Journal of Molecular Biology : journal. — 2007. — July (vol. 370, no. 5). — P. 870—886. — doi:10.1016/j.jmb.2007.04.086. — PMID 17559874.