Правило Фелкина — Ана
Правило Фелкина — Ана — общепринятый способ предсказания стереоселективности реакций нуклеофильного присоединения к карбонильной группе, находящейся рядом с хиральным центром (1,2-асимметрическая индукция), а также к ряду других реакций[1].
Модель
В основе данной модели лежит предположение о том, что атака нуклеофила по карбонильной группе происходит со стороны, противоположной наиболее объёмному заместителю RL при хиральном атоме углерода, причём сама атака, как известно, направлена под углом Бюрги — Дуница (107°) по отношению к карбонильной группе. Соответственно, могут реализоваться два варианта атаки, более выгодным из которых является тот, где нуклеофил подходит к субстрату со стороны наименее объёмного заместителя RS. Формально модели Крама и Фелкина — Ана приводят к одному и тому же стереохимическому результату, однако именно эта модель является более корректной для предсказания стереохимии реакций[2].
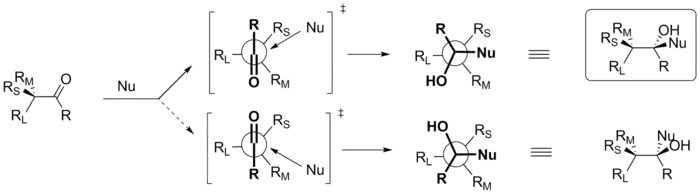
Конформация карбонильного соединения, предписываемая моделью Фелкина — Ана, была подтверждена расчётами Ана и Эйзенштейна как наиболее выгодная по энергии, в то время как конформации из моделей Крама, Корнфорта и Карабатсоса были менее выгодными и вносили не более 1 % вклада в общее состояние молекулы[3].
Согласно данной модели, стереоселективность реакции должна увеличиваться с увеличением заместителя R в кетонах, так как в этом случае траектория нуклеофила оказывается более приближенной к хиральному центру, увеличивая его влияние на стереоселективность. Например, триметилсилильная группа Si(CH3)3 по сравнению с атомом водорода даёт на порядок большую стереоселективность. При этом она может служить как вспомогательный заместитель, который можно легко удалить под действием фторид-иона[2]. Аналогично, в случае более крупных нуклеофилов стереоселективность увеличивается, поскольку крупные нуклеофилы более чувствительны к различию размеров между RM и RS. В связи с этим, полезным оказался подход, предполагающий использование более крупных противоионов нуклеофила для повышения селективности реакции (например, (C2H5)4Pb вместо C2H5MgBr)[1].
Модель Фелкина — Ана позволяет также предсказывать стереохимию реакцию α-галогенкетонов, при этом считается, что кетон принимает такую конформацию, в которой связь C=O и С-галоген взаимно перпендикулярны[2]. Было обнаружено, что стереоэлектронные факторы играют преимущественную роль в стабилизации переходного состояния с входящим нуклеофилом, поэтому заместители, проявляющие акцепторные свойства, считаются заместителями RL, независимо от их размера. Однако иногда стереоэлектронные и пространственные эффекты вступают в противоречие, из-за чего реакция теряет стереоселективность[1].
Модель также применена к тиокетонам и иминам, причём последние постоянно дают лучшие результаты, чем соответствующие кетоны[1].
См. также
- Правило Крама
- Модель хелатирования
Примечания
- Mengel, Reiser, 1999, с. 1195—1198.
- Смит, Дильман, 2009, с. 149—151.
- Nogradi M. Stereoselective Synthesis. A Practical Approach. — 2nd Edition. — VCH, 1995. — P. 107—108. — ISBN 3-527-29243-8.
Литература
- Смит В. А., Дильман А. Д. Глава 6.6.2. Правило Фелкина — Ана // Основы современного органического синтеза. — М.: Бином. Лаборатория знаний, 2009. — 750 с. — ISBN 978-5-94774-941-0.
- Mengel A., Reiser O. Around and beyond Cram's Rule (англ.) // Chem. Rev. — 1999. — Vol. 99, no. 5. — P. 1191—1224. — doi:10.1021/cr980379w. — PMID 11749444.