Перегруппировка Брука
Перегруппировка Брука — в органической химии реакция, в ходе которой органосилильная группа мигрирует с атома углерода на атом кислорода прилежащей гидроксильной группы. Конечным продуктом является силильный эфир. Данный процесс протекает под действием основания[1]. Реакция названа так по имени канадского химика Адриана Гиббса Брука (р. 1924).
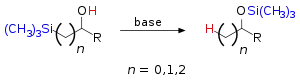
Заместители при атоме кремния могут быть алифатическими (например, метил) или ароматическими (фенил). Спирт может быть вторичным или третичным с алифатическими или ароматическими группами. В качестве основания может выступать амин, гидроксид натрия, органолитиевое соединение или сплав щелочных металлов (к примеру, натрий-калиевый).
Механизм реакции
Первой стадией данного процесса является отщепление протона от гидроксильной группы с помощью основания. Далее, образовавшийся алкоксианион выступает в роли нуклеофила и замещает метиленовую группу при атоме кремния. В качестве переходного состояния для данной стадии был предложен трехчленный цикл с нарастающим порядком Si-O связи и разрывающейся связью Si-C. Полученный карбанион быстро присоединяет протон из подходящего источника, например, растворителя, и превращается в нейтральный продукт — силильный эфир.
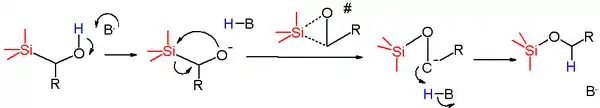
Было найдено, что энтальпия активации для реакции (триметилсилил)метилфенилметанола относительно мала, и в то же время энтропия активации имеет большое отрицательное значение. Это подтверждает предположение о циклическом переходном состоянии. Константы Гаммета для ряда пара-замещенных фенилметанолов свидетельствуют о том, что введение акцепторов стабилизирует отрицательный заряд в интермедиате и ускоряет реакцию.
Движущей силой перегруппировки Брука является образование сильной связи Si-O. В ходе реакции на разрыв связей Si-C и O-H суммарно тратится 451 + 427 = 878 кДж/моль, но при этом выделяется 809 (Si-O) + 338 (C-H) = 1147 кДж/моль.
Перегруппировка проходит с сохранением конфигурации атома кремния, что доказывается следующим Вальденовским циклом:
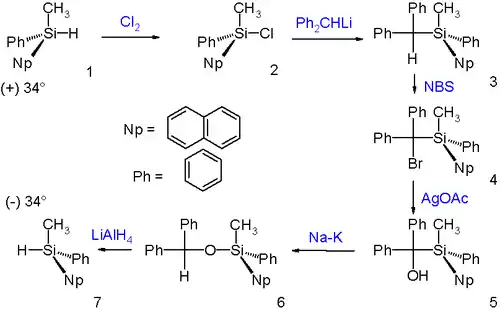
(+)-Силилгидрид реагирует с хлором, образуя соответствующий силилхлорид с сохранением конфигурации хирального центра. Затем следует реакция нуклеофильного замещения с дифенилметиллитием, которая протекает с обращением конфигурации. Далее в ходе бромирования и гидролиза конфигурация не меняется. Следующим шагом является собственно перегруппировка Брука. Наконец, восстановление алюмигидридом лития (протекающее без изменения конфигурации реакционного центра) приводит к (−)-энантиомеру исходного соединения.
Вариации
Известны случаи перегруппировки Брука в ацилсиланах[2]. Для некоторых силильных эфиров возможна ретроперегруппировка Брука[3].
Применение
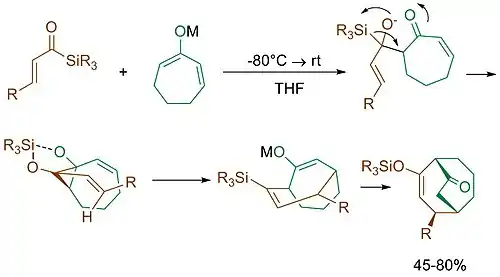
К. Такеда разработал метод стереоселективного синтеза восьмичленных циклов (одних из самых тяжелых в получении) с помощью тандема из перегруппировки Брука и [3+4]-аннелирования[4].
Примечания
- A. G. Brook. Molecular rearrangements of organosilicon compounds (англ.) // Accounts of Chemical Research : journal. — 1974. — Vol. 7, no. 3. — P. 77—84. — doi:10.1021/ar50075a003.
- Patrocinio, Amauri F. and Moran, Paulo J. S. Acylsilanes and their applications in organic chemistry. J. Braz. Chem. Soc., 2001, vol.12, no.1, p.07-31. ISSN 0103-5053. Статья онлайн
- Stereochemistry of the cyclization of 4-(t-butyldimethyl)siloxy-5-hexenyllithium: cis-selective ring-closure accompanied by retro-[1,4]-Brook rearrangement William F. Bailey and Xinglong Jiang ARKIVOC 2005 (vi) 25-32 Статья онлайн (недоступная ссылка)
- Takeda, K., Savada, Y., Sumi, K. Stereoselective formation of eight-membered carbocycles by Brook rearrangement-mediated [3+4] annulation (англ.) // Org. Lett. : journal. — 2002. — Vol. 4. — P. 1031—1033. — doi:10.1021/ol0256318.