Окислительно-восстановительные индикаторы
Окисли́тельно-восстанови́тельные индика́торы (редо́кс-индика́торы[К 1]) — вещества, которые применяются для определения точки эквивалентности в окислительно-восстановительных реакциях.
Чаще всего такими индикаторами являются органические соединения, которые проявляют окислительно-восстановительные свойства, и металлоорганические, в которых по достижении определённого потенциала меняется степень окисления металла. В обоих случаях изменения в структуре сопровождаются изменением окраски соединения.
Классификация

В зависимости от типа взаимодействия различают индикаторы:
- общие — меняют свою окраску в соответствии с потенциалом и независимо от природы веществ в растворе (например, дифениламин, метиленовый синий);
- специфические — дают реакцию только с определёнными соединениями (крахмал является индикатором на иод, тиоцианат-ионы — на катион Fe3+).
В зависимости от схемы перехода цвета индикаторы делят на:
- одноцветные — одна форма имеет цвет, другая — бесцветная;
- двухцветные — обе формы имеют собственные цвета.
Применяемые индикаторы должны соответствовать требованиям:
- хорошо растворяться в воде, кислотах и других типичных средах для титрования;
- быть устойчивыми к действию света, воздуха, других компонентов в растворе и стабильным при длительном хранении;
- окраски окисленной и восстановленной форм должны чётко отличаться;
- интервал потенциала, на котором происходит переход между формами, должен быть узким и отвечать скачку на кривой титрования;
- окраска должна меняться быстро, а ответная реакция быть полностью обратимой, не нести влияния посторонних реакций;
- изменение цвета раствора в конечный точке титрования должно быть чётким даже при наименьшем количестве добавленного индикатора.
Протекание реакции
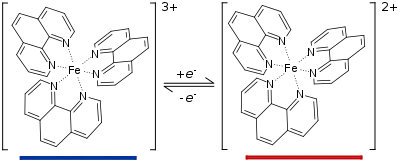
Общей схемой действия индикатора является обратная реакция восстановления его окисленной формы:
- Indox + ne- ⇌ Indred
Иногда взаимодействие также проходит с участием ионов H+:
- Indox + ne- + xH+⇌ Indred; (x может приобретать как положительных, так и отрицательных значений).
Эта реакция не влияет на поведение индикаторов, однако вызывает дополнительный расход титранта.
В общем виде потенциал индикатора, который участвует во взаимодействии, описывается уравнением Нернста:
- ,
- где E0ox/red — стандартный потенциал для данной пары форм, что соответствует условию [Indox]=[Indred]
Считается, что переход окраски заметен при десятикратном преобладании одной формы над другой. В этом случае множители в уравнении приобретут вид и , что равно 1 и -1 соответственно. Из этого предположения следует определение интервала перехода окраски индикатора pT:
Например, дифениламин, который имеет стандартный потенциал 0,76 В и совершает переход при участии двух электронов, меняет окраску в диапазоне 0,76±0,03 В. При значениях меньше 0,73 В он является бесцветным, при больших чем 0,79 преобладает фиолетовая форма. В промежутке 0,73—0,79 В окраска меняется постепенно.
Погрешности при использовании индикаторов
При использовании окислительно-восстановительных индикаторов выделяется три погрешности:
- химическая — отсутствие совпадения конечной точки титрования (момента смены окраски) с реальной точкой эквивалентности. Момент смены определяется потенциалом индикатора, на который могут влиять pH среды и ионная сила раствора, поэтому, например, если в ходе определения сильно меняется значение pH, момент смены окраски может не совпадать со скачком на кривой титрования и вызвать искажения результатов;
- визуальная — неспособность человеческого глаза точно различать изменения окраски;
- индикаторная — расход дополнительного количества титранта на взаимодействие с индикатором.
Распространённые индикаторы
| Индикатор | Цвет формы | Стандартный потенциал перехода, В[К 2] | |
|---|---|---|---|
| Indox | Indred | ||
| Нейтральный красный | красный | бесцветный | 0,24 |
| Метиленовый синий | синий | бесцветный | 0,53 |
| Дифениламин | фиолетовый | бесцветный | 0,76 |
| Дифенилбензидин | фиолетовый | бесцветный | 0,76 |
| Дифениламинсульфокислота | красно-фиолетовый | бесцветный | 0,85 |
| пара-Фенилантранилова кислота | красно-фиолетовый | бесцветный | 1,08 |
| Ферроин | синий | красный | 1,06 |
| Трис-(2,2'-дипиридилат) рутения | бесцветный | жёлтый | 1,33 |
См. также
Комментарии
- Термин редокс происходит от англ. redox: reduction — восстановление и oxidation — окисление.
- При [H+] = 1 моль/л (pH = 0).
Литература
- Пискарёва С. К. и др. Аналитическая химия. — Издание 2-е. — М.: Высшая школа, 1994. — С. 296—297. — ISBN 5-06-002179-3.
- Аналитическая химия. Химические методы анализа / Под ред. О. М. Петрухина. — М.: Химия, 1992. — С. 289—290. — ISBN 5-7245-0640-8.
- Жаровський Ф. Г., Пилипенко А. Т., П'ятницький І. В. Аналітична хімія. — 2-е. — К.: Вища школа, 1982. — С. 429—431.
- Бишоп, Э. Индикаторы / Пер. с англ. под ред. И. Н. Марова. — М.: Мир, 1976. — Т. 2. — С. 146—162.
