Метиловый оранжевый
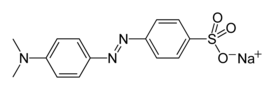
Метиловый оранжевый (метилоранж, англ. Methyl orange, гелиантин, 4- (4-диметиламино
| Метиловый оранжевый | |
|---|---|
   | |
 | |
| Общие | |
| Систематическое наименование |
4- (4 - диметиламинофенилазо ) бензолсульфонат натрия |
| Традиционные названия | Метиловый оранжевый, метилоранж |
| Хим. формула | C14H14N3O3SNa |
| Физические свойства | |
| Молярная масса | 327.3359 г/моль |
| Плотность | 1.28 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 300 °C[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | (при 50°С) 0.2 г/100 мл |
| • в этаноле | нерастворим |
| Классификация | |
| Рег. номер CAS | 547-58-0 |
| PubChem | 23673835 |
| Рег. номер EINECS | 208-925-3 |
| SMILES | |
| InChI | |
| ChemSpider | 16736152 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства
Внешний вид при обычных условиях: оранжево-жёлтые листочки или порошок, чешуйки. Метилоранж растворим в воде 0,2 г. на 100 г., лучше в горячей.
В растворах с рН 2 максимум поглощения находится на длине волны 505 нм (λmax=505 нм). Изобестическая точка соответствует длине волны 460 нм[2].
Переход окраски в водных растворах от красной к оранжево-жёлтой наблюдается в области рН 3,1-4,4 (в кислой среде красный, в щелочной — жёлтый).
На интервал перехода окраски влияют: температура, наличие в растворе солей, органических растворителей, белковых веществ и других. Влияние температуры наиболее значительно для индикаторов, являющихся слабыми основаниями: например, для метилового оранжевого при комнатной температуре окраска изменяется в пределах рН 3,1-4,4, а при 100°С — в пределах рН 2,5-3,7.
Токсичен.[3]
Применение
| Метиловый оранжевый | |
|---|---|
| (pH индикатор) | |
| Нижний предел | Верхний предел |
| pH 3.1 | pH 4.4 |
| Red | Yellow |
Применяется в качестве кислотно-основного индикатора, титранта при определении сильных окислителей, спектрофотометрическом определении окислителей (хрома, брома).
0,1%-ный водный раствор применяется в аналитической химии как индикатор.
Изменяет цвет от красного в кислотной среде (pH 3,1 до 4,4) к оранжевому в нейтральной и жёлтому в щелочной.
Получение
Лабораторный способ синтеза
Метиловый оранжевый получают, диазотируя сульфаниловую кислоту, а затем сочетая полученное вещество с диметиланилином.
Методика выполнения
Навеску сульфаниловой кислоты растворяют в 25 мл 2 М раствора едкого натра (2 г NaOH в 25 мл раствора). В этом же растворе затем растворяют навеску нитрита натрия массой 4 г. После этого раствор охлаждают льдом и приливают к 25 мл 2 М раствора соляной кислоты, охлаждаемого льдом (кроме наружного охлаждения кусочки льда могут быть помещены в раствор). Навеску диметиланилина растворяют в 5 мл 1 М соляной кислоты, охлаждают льдом и к охлажденному раствору приливают полученный выше раствор диазобензолсульфокислоты. Происходит образование красителя. Приливают ещё раствор едкого натра до сильнощелочной реакции. Из раствора выделяется натриевая соль красителя в виде оранжево-коричневых лепесткообразных кристаллов. Через несколько часов краситель отфильтровывают с отсасыванием и промывают на воронке 25 мл воды. Затем его тщательно отжимают на фильтровальной бумаге и сушат в фарфоровой чашке на водяной бане.
Мнемоническое правило
Для запоминания цвета индикатора метилового оранжевого в щелочах и кислотах служит мнемоническое стихотворение:
От щёлочи я жёлт как в лихорадке,
Я розовею от кислот, как от стыда.
И я бросаюсь в воду без оглядки,
Здесь я оранжевый практически всегда.
Ещё один способ запоминания:
Среды идут по порядку: кислая, нейтральная и щелочная. Стишок для запоминания цветов радуги идёт так же. «Каждый Охотник Желает…»
Кислая среда (pH < 7) — Каждый
Нейтральная среда (pH = 7) — Охотник
Щелочная среда (pH > 7) — Желает
Примечания
- Green F. J. The Sigma-Aldrich Handbook of Stains, Dyes and Indicators — Милуоки: 1990. — С. 461.
- В. М. Иванов. Оптические, цветометрические и кислотно-основные свойства метилового оранжевого. — 2010. — № 6. — С. 445.
- Acros Organics
