Метасиликат натрия
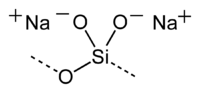
Метасилика́т на́трия — неорганическое соединение, соль щелочного металла натрия и метакремниевой кислоты с формулой , бесцветные или белые кристаллы, растворяется в холодной воде, образует кристаллогидраты.
| Метасиликат натрия | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Метасиликат натрия; силикат натрия |
| Традиционные названия | Кремнекислый натрий |
| Хим. формула | |
| Физические свойства | |
| Состояние | бесцветные или белые кристаллы |
| Молярная масса | 122,06 г/моль |
| Плотность | 2,4; 2,61 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1088; 1089 °C |
| Энтальпия | |
| • образования | −1535 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 18,820; 92,390 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,52 |
| Классификация | |
| Рег. номер CAS | 6834-92-0 |
| PubChem | 23266 |
| Рег. номер EINECS | 229-912-9 |
| SMILES | |
| InChI | |
| RTECS | VV9275000 |
| ChEBI | 60720 |
| Номер ООН | 3253 |
| ChemSpider | 21758 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Водный раствор известен под названием «жидкое стекло».
Нахождение в природе
Входит в состав редких минералов эртиксиита и натросилита [1].
История открытия
Метасиликат натрия был впервые обнаружен фламандским ятрохимиком и врачом Яном Баптиста ван Гельмонтом (1579—1644) в виде жидкого вещества, полученного при плавлении песка с избытком щёлочи. В 1646 году Иоганн Рудольф Глаубер (1604—1670) используя поташ и кремнезём получил вещество, которое он назвал «liquor silicum». И, наконец, в 1818 году немецкий химик и минеролог Иоганн Непомук фон Фукс (1774—1856) воздействуя на кремнёвую кислоту щёлочью получил вещество которое впоследствии стали называть «жидкое стекло»[2].
Получение
Сплавлением диоксида кремния с едким натром или карбонатом натрия:
или:
- .
Разложением ортосиликата натрия:
- .
Безводную соль получают нагреванием кристаллогидрата:
- .
Физические свойства
Метасиликат натрия образует бесцветные или белые кристаллы ромбической сингонии, пространственная группа C cm2, параметры ячейки a = 0,6078 нм, b = 1,053 нм, c = 0,4825 нм, Z = 4.
Хорошо растворим в холодной воде, концентрированные растворы образуют коллоидный раствор «жидкое стекло» гидрозоля переменного состава .
Из водных растворов выделяется кристаллогидрат , который плавится при 47 °С в собственной кристаллизационной воде и начинает разлагаться при температуре выше 100 °С.
В безводном твёрдом веществе метасиликатные анионы фактически является полимером, состоящим из тетраэдров с общими вершинами, а не отдельных ионов [3].
Также известны ряд кристаллогидратов с общей формулой , n = 5, 6, 8, 9 содержащие обособленный гидратированный, приблизительно тетраэдрический анион . Коммерчески доступны пентагидрат силиката натрия или и нонагидрат или [4]. Пентагидрат и нонагидрат имеют свои собственные номера CAS: 10213-79-3 и 13517-24-3 соответственно. Нонагидрат плавится при температуре 48 °C, а пентагидрат — при 72 °C[5].
Химические свойства
Водные растворы имеют щелочную реакцию из-за гидролиза по аниону.
Разлагается в горячей воде с гидролизом:
- .
Разлагается кислотами:
и щелочами:
- .
Реагирует с углекислым газом:
- .
Применение
- Компонент шихты в производстве неорганического стекла.
- Компонент жаростойких красок.
- Добавка в моющие средства и мыло.
- Для пропитки горючих материалов для придания им негорючести.
- В производстве жаростойких кислотоупорных бетонов.
- Наполнитель в облегчённых цементных растворах для цементирования буровых скважин.
- Водный раствор применяется как клей под названием «жидкое стекло»[6].
- в качестве пищевой добавки (E550), для предотвращающего слипания[7].
- для сохранения яиц. Когда свежие яйца погружаются в раствор силиката натрия, бактерии, способные разрушить яйцо, удаляются, сохраняя яйцо до девяти месяцев. Перед приготовлением в кипящей воде скорлупы яиц, законсервированных таким образом, необходимо проткнуть скорлупу, чтобы дать выход пару, поскольку скорлупа перестаёт быть пористой[8].
Примечания
- Mineraliensuche (Mineralienatlas)
- Метасиликат натрия (рус.) ?. https://nobel-group/by (8 октября 2017).
- Гринвуд, Норман Н., Эрншоу, А. Химия элементов в 2-х т. — М.: Бином. Лаборатория знаний, 2015.
- Wells A. F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- Record of Dinatriummetasilikat in the GESTIS Substance Database of the IFA, accessed on 2019-12-28
- Summers V. Uses of Sodium Metasilicate // sciencing.com (англ.)
- Système international de numérotation des additifs alimentaires, FAO/Codex Alimentarius, vol. 1A, 1995, p. 82, 96, 99.
- How to Store Fresh Eggs — Mother Earth News, 1977
Литература
- Химическая энциклопедия / Редколл.: И. Л. Кнунянц и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редколл.: Б. П. Никольский и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
