Медно-хлорный цикл
Цикл медь–хлор (цикл Cu – Cl) — четырехступенчатый термохимический цикл для производства водорода. Представляет собой гибридный процесс, в котором используются этапы термохимии и электролиза. Его максимальная температура составляет около 530 градусов по Цельсию. [1]
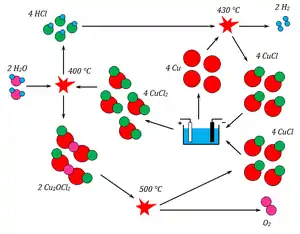
Цикл Cu – Cl включает четыре химические реакции расщепления воды, итоговая реакция которых разлагает воду на водород и кислород . Все остальные химические вещества возвращаются в цикл. Процесс Cu – Cl может быть связан с ядерными установками или другими источниками тепла, такими как солнечная энергия и промышленные отходы тепла, чтобы потенциально достичь более высокого КПД, меньшего воздействия на окружающую среду и более низких затрат на производство водорода по сравнению с любой другой традиционной технологией.
Цикл Cu – Cl — один из важнейших термохимических циклов, разрабатываемых Международным форумом «Поколение IV». Целью форума, куда входят более десятка стран по всему миру, является разработка ядерных реакторов следующего поколения для высокоэффективного производства как электроэнергии, так и водорода.
Описание процесса
Четыре реакции в цикле Cu – Cl перечислены ниже: [2] [3]
- 2 Cu + 2 HCl (г) → 2 CuCl (ж) + Н2 (г) (430-475 ° С)
- 2 CuCl2 + H2O ( г ) → Cu2OCl 2 + 2 HCl (г) (400 ° C)
- 2 Cu2OCl2 → 4 CuCl + O2 (г) (500 ° C)
- 2 CuCl → CuCl 2 (водн.) + Cu (электролиз при температуре окружающей среды)
- Чистая реакция: 2 H2O → 2 H2 + O2
- Обозначения: (г) - газ; (ж) - жидкость; (водн.) - водный раствор; остальные вещества находятся в твердой фазе.
Компания Atomic Energy of Canada Limited экспериментально продемонстрировала электролизер CuCl, в котором водород вырабатывается электролитически на катоде, а Cu (I) окисляется до Cu (II) на аноде, тем самым объединив указанные выше этапы 1 и 4 для исключения промежуточного производства и последующей транспортировки твердой меди. [4]
Примерно 50% тепла, необходимого для протекания этой реакции, может улавливаться самой реакцией. Другое тепло может быть получено с помощью любого подходящего процесса. Недавние исследования были сосредоточены на схеме когенерации с использованием отработанного тепла ядерных реакторов, в частности реактора CANDU с водой сверхкритического давления[4].
Преимущества и недостатки
Преимуществами цикла медь-хлор являются более низкие рабочие температуры, возможность использования низкопотенциального отходящего тепла для повышения энергоэффективности и потенциально более дешевые материалы. По сравнению с другими термохимическими циклами, процесс Cu – Cl требует относительно низких температур до 530 °C (990 °F) .
Еще одним важным достоинством этого цикла является относительно низкое напряжение (следовательно, низкий расход электроэнергии), необходимое для электрохимической стадии (от 0,6 до 1,0 В, возможно, даже 0,5, если может быть достигнута более низкая плотность тока). [5] Общий КПД цикла Cu – Cl составляет чуть более 43% [6] исключая дополнительные потенциальные выгоды от использования отходящего тепла в цикле.
Работа с твердыми частицами в процессе, где есть агрессивные рабочие жидкости, представляет собой проблему для разработки инженерного оборудования. Среди прочего в настоящее время используются следующие материалы: напыляемые покрытия, никелевые сплавы, облицованная стеклом сталь, огнеупорные и другие современные материалы. [7]
См. также
Примечания
- Solar power for thermochemical production of hydrogen
- Rosen, M.A., Naterer, G.F., Sadhankar, R., Suppiah, S., "Nuclear-Based Hydrogen Production with a Thermochemical Copper-Chlorine Cycle and Supercritical Water Reactor", Canadian Hydrogen Association Workshop, Quebec, October 19 – 20, 2006. (PDF) Архивировано 6 июля 2011 года..
- Lewis, M. and Masin, J., "An Assessment of the Efficiency of the Hybrid Copper-Chloride Thermochemical Cycle", Argonne National Laboratory, University of Chicago, 2 November 2005. (PDF).
- Naterer, G. F. (2009). “Recent Canadian Advances in Nuclear-Based Hydrogen Production and the Thermochemical Cu-Cl Cycle”. International Journal of Hydrogen Energy. 34 (7): 2901—2917. DOI:10.1016/j.ijhydene.2009.01.090.
- Dokiya, M. (1976). “Hybrid Cycle with Electrolysis Using Cu-Cl System” (PDF). International Journal of Hydrogen Energy. 1 (2): 117—121. DOI:10.1016/0360-3199(76)90064-1. Дата обращения 2009-02-27.
- Chukwu, C., Naterer, G. F., Rosen, M. A., "Process Simulation of Nuclear-Produced Hydrogen with a Cu-Cl Cycle", 29th Conference of the Canadian Nuclear Society, Toronto, Ontario, Canada, June 1–4, 2008. Archived copy (недоступная ссылка). Дата обращения: 4 декабря 2013. Архивировано 20 февраля 2012 года.
- Hydrogen Website of UOIT (University of Ontario Institute of Technology) Архивировано 22 мая 2011 года.