Цикл оксида железа
Цикл оксида железа (Fe3O4/FeO) — двухступенчатый термохимический цикл, используемый для производства водорода . [1] Он основан на восстановлении и последующем окислении ионов железа, а именно на восстановлении и окислении между Fe3+ и Fe2+. Ферриты, или оксид железа, участвуют в цикле в форме шпинели, и в зависимости от условий реакции легирующие металлы и материал носителя образуют либо вюститы, либо различные шпинели.
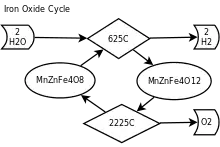
Описание процесса
В термохимическом двухэтапном процессе разделения воды используются две окислительно-восстановительные стадии. Этапы производства солнечного водорода с помощью двухступенчатого цикла на основе железа:
Где символом M обозначен металл Fe, Co, Ni, Mn, Zn или их смесь.
Стадия эндотермического восстановления (1) проводится при высоких температурах, превышающих 1400 С, хотя «цикл герцинита» может проходить при 1200 С. Стадия окислительного расщепления воды (2) происходит при более низких температурах ~1000 С, в ней образуется исходный ферритовый материал и газообразный водород. Температурный уровень реализуется с помощью геотермального тепла от магмы [2] или солнечной энергетической башни и набора гелиостатов для сбора солнечной тепловой энергии.
Герцинитовый цикл
Как и традиционный цикл оксида железа, цмкл герцинита основан на окислении и восстановлении атомов железа. Однако в отличие от традиционного цикла ферритный материал реагирует со вторым оксидом металла, оксидом алюминия, а не просто разлагается. Реакции протекают через следующие две реакции:
Стадия восстановления герцинитовой реакции протекает при температуре на 200 С ниже, чем при традиционном цикле разделения воды (1200 С). [3] Это приводит к меньшим потерям на излучение, которые пропорциональны четвёртой степени температуры.
Преимущества и недостатки
Преимущества ферритовых циклов: более низкие температуры восстановления, чем другие двухступенчатые системы, не образуются металлические газы, высокая удельная производительность по H2, нетоксичность используемых элементов и большое количество составляющих элементов.
Недостатками ферритных циклов являются: одинаковая температура восстановления и плавления шпинелей (за исключением герцинитового цикла, поскольку алюминаты имеют очень высокие температуры плавления) и медленные скорости реакции окисления или расщепления воды.
См. также
Примечания
- Project PD10
- Sentech 2008-Analysis of geothermally produced hydrogen on the big island of Hawaii
- Sheffe, Jonathan (2010). “A spinel ferrite/hercynite water-splitting redox cycle”. International Journal of Hydrogen Energy. 35 (8): 3333—3340. DOI:10.1016/j.ijhydene.2010.01.140.