Кокколитофориды
Кокколитофориды (от др.-греч. κόκκος ‘зернышко’, λίθος ‘камень’, φορέω ‘ношу’) — группа одноклеточных планктонных гаптофитовых водорослей, образующих на поверхности известковые пластинки — кокколиты. Кокколитофориды составляют существенную (до 98 %) часть нанопланктона, а их известковые скелеты, входящие в состав донных отложений, часто используются для определения возраста горных пород. Играют важную роль в биогеохимии океана, вызывают[1] цветения вод в полярных широтах (особенно в Баренцевом море) и в Чёрном море[2]. Кокколитофоры являются одними из основных известняк-продуцирующих организмов в Мировом океане, наряду с фораминиферами. Эти водоросли участвуют в обмене углерода между океаном и атмосферой, и являются важным звеном поглощения неорганического углерода из атмосферы.
| Кокколитофориды | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
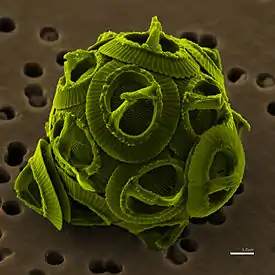 Gephyrocapsa oceanica | ||||||||||
| Научная классификация | ||||||||||
|
Домен: Клада: Haptista Класс: Prymnesiophyceae Порядок: Coccosphaerales Семейство: Кокколитофориды |
||||||||||
| Международное научное название | ||||||||||
| Coccolithaceae Poche, 1913 | ||||||||||
| ||||||||||
Структура
Кокколитофориды представляют собой сферическую клетку диаметром 5-100 микрометров, окружённую известковыми пластинками, называемыми кокколитами, диаметром 2-25 микрометров. Каждая клетка содержит два хлоропласта, находящиеся вокруг ядра.[3]
Экзоскелет(коккосфера)
Каждая клетка покрыта экзоскелетом, состоящим из слоя кокколитов.[4] Они создаются внутри клетки, и в то время как некоторые виды сохраняют один слой на протяжении всей жизни, производя новые кокколиты только по мере роста клетки, другие постоянно производят и сбрасывают кокколиты.
Состав
Основным компонентом кокколитов является карбонат кальция. Он прозрачен, поэтому фотосинтетическая активность организмов не нарушается.[5]
Формирование
Кокколиты образуются в результате процесса биоминерализации, называемого кокколитогенезом.[3] Как правило, кальцификация кокколитов происходит в присутствии света. Хотя процесс биоминерализации еще не полностью изучен, он жестко регулируется кальциевой сигнализацией. Образование кальцита начинается в комплексе Гольджи, где белки зарождают образование кристаллов CaCO3, а сложные кислотные полисахариды контролируют форму и рост этих кристаллов.[6] По мере производства каждой чешуйки, они экспортируются в везикулу аппарата Гольджи и добавляются к внутренней поверхности коккосферы. В зависимости от стадии жизненного цикла могут образовываться два различных типа кокколитов. Голококколиты образуются только в гаплоидной фазе, лишены радиальной симметрии и состоят из сотен или тысяч мельчайших (около 0,1 мкм) ромбических кристаллов кальцита. Считается, что эти кристаллы частично формируются вне клетки. Гетерококколиты встречаются только в диплоидной фазе, имеют радиальную симметрию и состоят из относительно небольшого числа сложных кристаллических частиц (менее 100). Комбинированные коккосферы, содержащие как голококколиты, так и гетерококколиты, наблюдаются в клетках переходной стадии жизненного цикла кокколитофоров. Коккосферы некоторых видов сильно модифицированы различными отростками, состоящими из специализированных кокколитов.[7]

Функция
Хотя точная функция коккосферы неясна, были предложены несколько вероятных функций. Наиболее очевидно, что кокколиты защищают клетку от хищников. Также кокколиты поддерживают стабильный рН. В процессе фотосинтеза углекислый газ удаляется из воды, делая ее более щелочной. Кальцификация также удаляет углекислый газ, но последующие химические реакции приводят к тому, что среда наоборот становится более кислой. Таким образом, сочетание фотосинтеза и кальцификации выравнивает друг друга в отношении изменений рН.[8] Кроме того, экзоскелет даёт преимущество в производстве энергии, поскольку кокколитогенез тесно связан с фотосинтезом. Органическое осаждение карбоната кальция из бикарбонатного раствора производит свободный углекислый газ непосредственно в клеточном теле водоросли, и этот дополнительный источник газа доступен клетке для фотосинтеза. Есть предположение, что экзоскелет служит барьером, подобным клеточной стенке, для изоляции внутренней среды клетки.[9] Более специфические защитные функции экзоскелета могут включать защиту от изменений осмотического давления, химических или механических повреждений и коротковолнового света. Было также высказано предположение, что вес нескольких слоев кокколитов позволяет клетке погружаться в более низкие, более богатые питательными веществами слои воды и, наоборот, что кокколиты добавляют плавучесть, останавливая клетку от погружения на опасные глубины.
Клеточная анатомия
В каждой коккосфере заключена отдельная клетка с мембраносвязанными органеллами. Два больших хлоропласта с коричневым пигментом расположены по обе стороны клетки и окружают ядро, митохондрии, аппарат Гольджи, эндоплазматический ретикулум и другие органеллы. Каждая клетка также имеет две жгутиковые структуры, которые служат не только для движения, но участвуют в митозе и в формировании цитоскелета.[10] У некоторых видов также присутствует функциональная или рудиментарная гаптонема.[11] Этот уникальный для протистов вырост скручивается и раскручивается ответ на внешние раздражители. Несмотря на то, что гаптонема плохо изучена, считается, что её роль состоит в захвате добычи.[10]
Значение в глобальном изменении климата
Влияние на цикл углерода
Кокколитофоры оказывают как долгосрочное, так и краткосрочное воздействие на углеродный цикл. Создание экзоскелета из кокколитов требует поглощения растворенного углерода и кальция. Карбонат кальция и углекислый газ образуются из кальция и бикарбоната в результате следующей химической реакции:
Ca2+ + 2HCO3− ⇌ CaCO3 + CO2 + H2O.[12]
Поскольку кокколитофориды являются фотосинтетическими организмами, они способны использовать для фотосинтеза часть CO2, выделяющегося в реакции кальцификации.[13]
Однако, образование карбоната кальция приводит к снижению поверхностной щелочности океана, и в таких условиях CO2 выбрасывается обратно в атмосферу.[14] Исследователи заявляют, что частое цветение кокколитофоридов может способствовать глобальному потеплению в краткосрочной перспективе.[15] Более широко распространенная идея гласит, что в долгосрочной перспективе кокколитофориды способствуют общему снижению концентрации CO2 в атмосфере. Во время кальцификации поглощаются два атома углерода, и один из них входит в состав карбоната кальция. Этот карбонат кальция опускается на дно океана в виде кокколитов и становится частью осадочных пород. Таким образом, кокколитофориды поглощают часть выброшенного углерода, уменьшая количество парниковых газов в атмосфере.[15]
Эволюционные реакции на закисление океана
Исследования также показывают, что закисление океана из-за увеличения концентрации CO2 в атмосфере может повлиять на механизм кальцификации кокколитофоридов. Это может не только повлиять на увеличение популяции или производство кокколитов, но также может вызвать эволюционную адаптацию в течение более длительных периодов времени. К примеру, кокколитофориды используют Н+ ионные каналы, чтобы откачивать Н+ ионы из клетки во время производства кокколитов. Это позволяет им избежать ацидоза, так как в противном случае производство кокколитов привело бы к токсическому избытку ионов Н+. Когда функция этих ионных каналов нарушается, кокколитофоры останавливают процесс кальцификации, чтобы избежать ацидоза. Низкая щелочность океана ухудшает функцию ионных каналов и делает кокколитофориды уязвимыми для закисления океана.[16] В 2008 году, полевые данные, свидетельствующие об увеличении кальцификации новообразованных океанических отложений, содержащих кокколитофориды, подкрепили первые в истории экспериментальные данные, свидетельствующие о том, что увеличение концентрации CO2 в океане приводит к увеличению кальцификации этих организмов. Уменьшение массы кокколитов связано как с увеличением концентрации CO2, так и с уменьшением концентрации CO32– в Мировом океане. Однако, некоторые виды, такие как Calcidiscus leptoporus, не подвержены такому воздействию, в то время как наиболее распространенный вид кокколитофоридов, E. huxleyi, может быть поражен (результаты исследований неоднозначны).[17][18] Кроме того, в условиях низкой насыщенности CaCO3, вопреки прогнозам, были обнаружены сильно кальцинированные кокколитофориды. Понимание влияния закисления океана на виды кокколитофоридов необходимо для прогнозирования будущего химического состава океана, в частности его углеродного состава.
Влияние на палеонтологическую летопись
Особый интерес представляют окаменелости, датируемые Палеоценовым-Эоценовым термическим максимумом, произошедшим. Считается, что 55 миллионов лет назад уровень содержащегося в океане CO2, наиболее соответствует текущим показателям.[19]
Литература
- Геологический словарь, М.: Недра, 1978
- Ботаника: В 4 т. Т. 2: Водоросли и грибы, Белякова Г. А., Дьяков Ю. Т., и др, Academia, 2006
Примечания
- Петренко Д. А., Заболотских Е. В., Поздняков Д. В., Сычев В. И., Карлин Л. Н. Количественная оценка годового продуцирования кокколитофорами взвешенного неорганического углерода в Арктическом океане и его многолетней динамики (2002-2010) по спутниковым синергетическим данным в видимом, инфракрасном и микроволновом диапазонах // Девятая открытая Всероссийская конференция. «Современные проблемы дистанционного зондирования Земли из космоса». Москва, ИКИ РАН, 14-18 ноября 2011 г. Сборник тезисов конференции
- Цветение Черного моря: взгляд из космоса
- N. R. Moheimani, J. P. Webb, M. A. Borowitzka. Bioremediation and other potential applications of coccolithophorid algae: A review (англ.) // Algal Research. — 2012-10-01. — Vol. 1, iss. 2. — P. 120–133. — ISSN 2211-9264. — doi:10.1016/j.algal.2012.06.002.
- Evolution of primary producers in the sea. — Amsterdam: Elsevier Academic Press, 2007. — 1 online resource (xiii, 441 pages, 16 unnumbered pages of plates) с. — ISBN 978-0-08-055051-0, 0-08-055051-7.
- Hogan, M.C. ""Coccolithophores"". In Cleveland, Cutler J. (ed.). Encyclopedia of Earth. Washington, D.C.: Environmental Information Coalition, National Council for Science and the Environment.
- de Vargas, C.; Aubrey, M.P.; Probert, I.; Young, J. (2007). "From coastal hunters to oceanic farmers.". In Falkowski, P.G.; Knoll, A.H. (eds.). Origin and Evolution of Coccolithophores. Boston: Elsevier. pp. 251–285.
- Jeremy R. Young, Harald Andruleit, Ian Probert. Coccolith Function and Morphogenesis: Insights from Appendage-Bearing Coccolithophores of the Family Syracosphaeraceae (haptophyta)1 (англ.) // Journal of Phycology. — 2009. — Vol. 45, iss. 1. — P. 213–226. — ISSN 1529-8817. — doi:10.1111/j.1529-8817.2008.00643.x.
- Microscopic marine plants bioengineer their environment to enhance their own growth
- Westbroek, P.; et al. (1983), "Calcification in Coccolithophoridae: Wasteful or Functional?", Ecological Bulletins: 291–299
- Coccolithophores : from molecular processes to global impact. — Berlin: Springer, 2004. — xiii, 565 pages с. — ISBN 3-540-21928-5, 978-3-540-21928-6.
- Richard W. Jordan. Haptophyta (англ.) // eLS. — American Cancer Society, 2012. — ISBN 978-0-470-01590-2. — doi:10.1002/9780470015902.a0001981.pub2.
- Robin Mejia. Will Ion Channels Help Coccolithophores Adapt to Ocean Acidification? (англ.) // PLOS Biology. — 2011-06-21. — Vol. 9, iss. 6. — P. e1001087. — ISSN 1545-7885. — doi:10.1371/journal.pbio.1001087.
- Luke Mackinder, Glen Wheeler, Declan Schroeder, Ulf Riebesell, Colin Brownlee. Molecular Mechanisms Underlying Calcification in Coccolithophores // Geomicrobiology Journal. — 2010-09-10. — Т. 27, вып. 6-7. — С. 585–595. — ISSN 0149-0451. — doi:10.1080/01490451003703014.
- Nicholas R. Bates, Anthony F. Michaels, Anthony H. Knap. Alkalinity changes in the Sargasso Sea: geochemical evidence of calcification? (англ.) // Marine Chemistry. — 1996-01-01. — Vol. 51, iss. 4. — P. 347–358. — ISSN 0304-4203. — doi:10.1016/0304-4203(95)00068-2.
- M. E Marsh. Regulation of CaCO3 formation in coccolithophores (англ.) // Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. — 2003-12-01. — Vol. 136, iss. 4. — P. 743–754. — ISSN 1096-4959. — doi:10.1016/S1096-4959(03)00180-5.
- T. Tyrrell, P. M. Holligan, C. D. Mobley. Optical impacts of oceanic coccolithophore blooms (англ.) // Journal of Geophysical Research: Oceans. — 1999. — Vol. 104, iss. C2. — P. 3223–3241. — ISSN 2156-2202. — doi:10.1029/1998JC900052.
- L. Beaufort, I. Probert, T. de Garidel-Thoron, E. M. Bendif, D. Ruiz-Pino. Sensitivity of coccolithophores to carbonate chemistry and ocean acidification (англ.) // Nature. — 2011-08. — Vol. 476, iss. 7358. — P. 80–83. — ISSN 1476-4687. — doi:10.1038/nature10295.
- Can seashells save the world? (англ.). The Independent (23 октября 2011). Дата обращения: 17 января 2021.
- Jean M. Self-Trail, David S. Powars, David K. Watkins, Gregory A. Wandless. Calcareous nannofossil assemblage changes across the Paleocene–Eocene Thermal Maximum: Evidence from a shelf setting (англ.) // Marine Micropaleontology. — 2012-09-01. — Vol. 92-93. — P. 61–80. — ISSN 0377-8398. — doi:10.1016/j.marmicro.2012.05.003.