Карбонилфторид
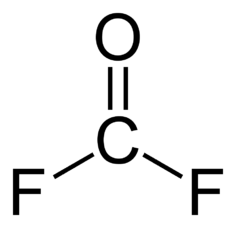
Карбонилфторид (оксофторид углерода, дифторфосген, дифторангидрид угольной кислоты) — органическое соединение, имеющее химическую формулу COF2. Как и его аналог фосген, это бесцветный токсичный газ с резким запахом. Молекула карбонилфторида имеет симметрию групп C2v.
Карбонилфторид | |
|---|---|
 | |
 | |
 | |
Общие | |
| Систематическое наименование | Карбонилфторид Оксофторид углерода Фторфосген |
| Хим. формула | CF₂O |
Физические свойства | |
| Молярная масса | 66,01 г/моль |
Термические свойства | |
| Т. плав. | −111,26 ℃ |
| Т. кип. | −84,57 ℃ |
Структура | |
| Дипольный момент | 0,95 Д |
Классификация | |
| Номер CAS | 353-50-4 |
| PubChem | 9623 |
| ChemSpider | 9246 |
| Номер EINECS | 206-534-2 |
| RTECS | FG6125000 |
| Номер ООН | 2417 |
C(=O)(F)F | |
InChI=1S/CF2O/c2-1(3)4 | |
Безопасность | |
| Токсичность | высокотоксичен
|
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Применяется в органическом синтезе.
Получение и свойства
Карбонилфторид может быть получен из фосгена в результате реакции последнего с фтороводородом или фторидами щелочных металлов, или окислением угарного газа при введении фтора в его молекулу. Сделано это может быть, к примеру, фторидом серебра(II).
Другие способы синтеза карбонилфторида:
- реакция фосгена со фторидом натрия или фторидом сурьмы(V) в ацетонитриле;
- реакция оксида углерода с фтором;
- реакция оксида серы(VI) с CF2Br2 в присутствии солей ртути.
- разложение тетрафторметана с его последующим окислением кислорода воздуха при 1100 °C.
Карбонилфторид является стабильным соединением только в сухом воздухе. Даже при небольших примесях паров воды он легко гидролизуется до фтороводорода и углекислого газа[1].
Легко реагирует с нуклеофильными реагентами:
Со фторалкенами карбонилфторид в присутствии фторид-ионов образует фторангидриды и кетоны:
Токсичность
ПДК карбонилфторида 0,5 мг/м3 (обязателен контроль фтора). Карбонилфторид приблизительно в 5 раз менее токсичен, чем фосген.
Примечания
- M. W. Farlow, E. H. Man, C. W. Tullock «Carbonyl Fluoride» Inorganic Syntheses, 1960, Volume 6, pp, 155—158. doi:10.1002/9780470132371.ch48
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.
