Карбонат аммония
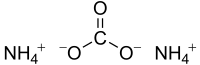
Карбонат аммония, углекислый аммоний, (NH4)2CO3 — аммониевая соль угольной кислоты.
| Карбонат аммония | |
|---|---|
 | |
 | |
| Общие | |
| Традиционные названия | углекислый аммоний |
| Хим. формула | (NH4)2CO3 |
| Физические свойства | |
| Плотность | 1,6 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 60 °C |
| Химические свойства | |
| Растворимость | |
| • в воде |
растворим (0 °C) 100,1 (15 °C) Разл. (100 °C) |
| Классификация | |
| Рег. номер CAS | 506-87-6 |
| PubChem | 10480 |
| Рег. номер EINECS | 208-058-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E503(i) и E503 |
| ChemSpider | 10048 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства
Бесцветные кристаллы соединения хорошо растворимы в воде. Карбонат аммония очень неустойчив как на воздухе, так и в растворе, так как уже при комнатной температуре выделяет аммиак, превращаясь в гидрокарбонат аммония . При температуре 60 °C быстро распадается на , и .
Подвергается гидролизу:
Применение
На процессе разложения, связанном с выделением газов, основано применение карбоната аммония вместо дрожжей в хлебопечении и кондитерской промышленности (пищевая добавка Е503). Получают карбонат аммония взаимодействием газообразных , и при быстром охлаждении продуктов реакции. Технический продукт содержит наряду с соединение гидрокарбоната аммония с карбаматом аммония .
Карбонат аммония применяется для получения сульфата аммония из гипса по реакции
При этом карбонат аммония можно вводить в виде раствора (жидкостный процесс конверсии), вместо карбоната аммония можно вводить газообразные и (газовый процесс конверсии), а также можно вводить газообразные и дополнительно к раствору в количестве 10—15 % стехиометрического количества в расчёте на (газожидкостный процесс конверсии). В последнем случае при растворении газов выделяется дополнительная теплота, необходимая для протекания реакции.[1] Карбонат аммония может рассматриваться как источник карбонат-ионов и в перспективе может применяться, например, для осаждения солей магния для отделения его от солей калия. При добыче калия из морской воды соли калия выделяются вместе с солями магния и не могут быть очищены от него перекристаллизацией. При добавлении карбоната аммония магний выпадает в осадок в виде карбоната, в растворе остаются в основном хлорид калия и хлорид аммония, которые впоследствии могут быть разделены (рекристаллизацией или возгонкой), либо не разделяться, а использоваться как азотно-калийное удобрение. Также карбонат аммония применяется:
- в лекарственных препаратах (сиропы от кашля, нашатырь и др.);
- в качестве ускорителя ферментации при производстве вина;
- в качестве компонента огнетушащих составов
- в косметике в качестве красителей
- в качестве компонента раствора чистки стволов огнестрельного оружия (РЧС)
Примечания
- Фосфогипс (недоступная ссылка). Справочник стройматериалов. Суперсептик.Ру. Архивировано 5 июля 2010 года.
Литература
- Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — 623 с. — 100 000 экз.

