Глиоксилатный цикл
Глиоксила́тный цикл, или глиоксила́тный шунт[1] — анаболический путь, имеющийся у растений, бактерий, протистов и грибов, представляет собой видоизменённый цикл трикарбоновых кислот. Глиоксилатный цикл служит для превращения ацетил-СоА в сукцинат, который далее используется для синтеза углеводов[2]. У микроорганизмов он обеспечивает утилизацию простых углеродных соединений в качестве источника углерода, когда более сложные источники, например, глюкоза, недоступны[3], а также может считаться одной из анаплеротических реакций цикла трикарбоновых кислот, восполняющей количества сукцината и малата[1]. Считается, что у животных глиоксилатный цикл отсутствует (подтверждённое исключение составляют нематоды на ранних стадиях своего эмбриогенеза), однако в последние годы в некоторых тканях животных были обнаружены ключевые ферменты цикла — малатсинтаза и изоцитратлиаза[2][4].
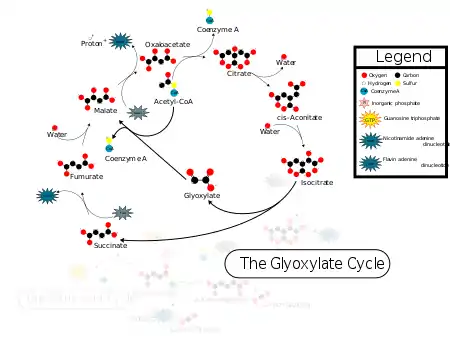
Ферменты и реакции глиоксилатного цикла были открыты Хансом Корнбергом и Хансом Адольфом Кребсом[5].
Механизм
У растений, некоторых беспозвоночных и некоторых микроорганизмов (в том числе бактерии Escherichia coli и дрожжей) ацетат может служить как источником энергии, так и предшественником фосфоенолпирувата, который далее используется для синтеза углеводов. У этих организмов ферменты глиоксилатного цикла катализируют превращение ацетата в сукцинат:
- 2 Ацетил-СоА + NAD+ + 2H2O → сукцинат + 2СоА + NADH + H+.
В ходе глиоксилатного цикла ацетил-СоА соединяется с оксалоацетатом с образованием цитрата, а цитрат превращается в изоцитрат, как и в цикле трикарбоновых кислот. Однако следующим шагом является не отщепление от изоцитрата водорода ферментом изоцитратдегидрогеназой, а расщепление изоцитрата на сукцинат и глиоксилат под дейстствием изоцитратлиазы. Механизм этой альдольной реакции показан ниже:
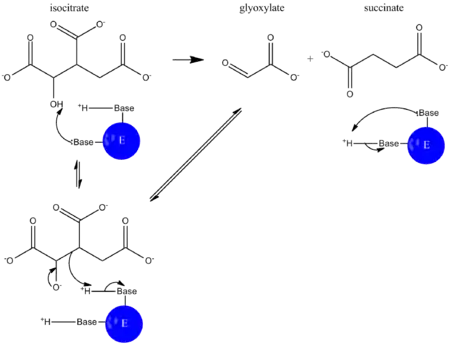
Глиоксилат после этого конденсируется со второй молекулой ацетил-СоА, образуя малат под действием малатсинтазы, а сукцинат покидает цикл. Малат далее окисляется в оксалоацетат, который может соединиться с новой молекулой ацетил-СоА и начать новый оборот цикла. В ходе каждого оборота глиоксилатного цикла используются две молекулы ацетил-СоА и образуется одна молекула сукцината, который в дальнейшем может использоваться в биосинтетических процессах. Сукцинат может быть преобразован через фумарат и малат в оксалоацетат, который далее может превратиться в фосфоенолпируват под действием фосфоенолпируваткарбоксикиназы, а фосфоенолпируват в ходе глюконеогенеза даёт глюкозу. У животных глиоксилатный цикл не происходит, и в связи с этим они неспособны получать глюкозу из липидов (ацетил-СоА образуется при β-окислении жирных кислот)[6].
Функции у различных организмов
Растения

У растений ферменты глиоксилатного цикла находятся в мембраносвязанных органеллах — глиоксисомах, представляющих собой специализированные пероксисомы (названы по протекающему в них циклу[7]). Ферменты, одновременно участвующие и в цикле трикарбоновых кислот, и в глиоксилатном цикле, имеют по два изофермента, один из которых локализуется в митохондриях, а другой — в глиоксисомах. Глиоксисомы не присутствуют постоянно во всех растительных тканях. Они образуются в богатых липидами семенах при их прорастании, ещё до того, как развивающееся растение сможет само образовывать глюкозу в ходе фотосинтеза. Кроме ферментов глиоксилатного цикла, в глиоксисомах находятся все ферменты, необходимые для деградации жирных кислот, запасённых к семенах. Ацетил-СоА, образующийся при β-окислении жирных кислот, превращается в сукцинат в ходе глиоксилатного цикла, и сукцинат транспортируется в митохондрии, где он вовлекается в цикл трикарбоновых кислот и превращается в малат. Цитозольный изофермент малатдегидрогеназы окисляет малат до оксалоацетата, который в свою очередь может превратиться в фосфоенолпируват. Последний вовлекается в глюконеогенез и даёт в конечном итоге глюкозу. Таким образом, прорастающее семя может переводить углерод, запасённый в липидах, в глюкозу[6].
Грибы и микроорганизмы
У грибов ферменты глиоксилатного цикла локализуются в пероксисомах. У некоторых патогенных грибов глиоксилатный цикл может служить для совершенно других целей. Концентрация двух ключевых ферментов цикла — изоцитратлиазы и малатсинтазы — значительно возрастает при контакте гриба с человеком, которого этот гриб поражает. У некоторых видов таких грибов мутанты, лишённые изоцитратлиазы, имеют сниженную вирулентность по сравнению с диким типом, как показали исследования на мышах. Причины такой связи в настоящий момент исследуются, однако можно заключить, что глиоксилатный цикл необходим для поддержания вирулентности этих патогенов[8].
Согласно новейшим данным, у растений и грибов ферменты глиоксилатного цикла локализованы не только внутри глиоксисомы: некоторые из них находятся снаружи, поэтому протекание глиоксилатного цикла включает транспорт некоторых его промежуточных соединений через мембрану пероксисомы[9].
Благодаря наличию глиоксилатного цикла некоторые микроорганизмы могут расти в среде, содержащей ацетат или жирные кислоты в качестве единственного источника углерода[10].
Животные
Принято считать, что животные неспособны к осуществлению глиоксилатного цикла, поскольку до недавнего времени не было никаких доказательств наличия у них двух ключевых ферментов цикла — изоцитратлиазы и малатсинтазы. Однако некоторые исследования показывают, что этот цикл имеется у некоторых, если не всех, позвоночных[4][11]. В частности, некоторые исследования показали, что компоненты глиоксилатного цикла присутствуют в больших количествах в печени курицы. Эти и подобные им данные дают основания предполагать, что теоретически глиоксилатный цикл может осуществляться и более сложно организованными позвоночными[12]. Другие исследования приводят доказательства того, что глиоксилатный цикл имеется у некоторых насекомых и морских беспозвоночных, а также нематод (в последнем случае наличие глиоксилатного цикла чётко подтверждено). Впрочем, другие исследования такие выводы опровергают[13]. По поводу наличия цикла у млекопитающих также нет единого мнения: например, в одной работе указывается, что глиоксилатный цикл активен у медведей в зимней спячке[14], однако более поздние исследования оспаривают этот вывод[15]. С другой стороны, в геномах плацентарных млекопитающих не было идентифицировано ни одного гена, который кодировал бы изоцитратлиазу и малатсинтазу, хотя, по-видимому, малатсинтаза может быть активна у неплацентарных млекопитающих и других позвоночных[2]. Более того, предполагается, что гены, кодирующие эти ферменты, у млекопитающих находятся в виде псевдогенов, то есть такие гены не совершенно отсутствуют у млекопитающих, а лишь находятся в «выключенном» состоянии[2]. Возможно, в регуляцию глиоксилатного цикла у позвоночных вовлечён витамин D[12][16].
Впрочем, в отсутствии глиоксилатного цикла в клетках млекопитающих есть и свои выгоды. Наличие глиоксилатного цикла у некоторых патогенных микроорганизмов и отсутствие его у людей даёт возможности для создания антибиотиков, блокирующих это цикл: они были бы губительны для зависимых от глиоксилатного цикла микроорганизмов и при этом безвредны для людей[3].
Регуляция
В прорастающих семенах ферментативные превращения дикарбоновых и трикарбоновых кислот происходят в трёх внутриклеточных компартментах: митохондриях, глиоксисомах и цитозоле. Между этими компартментами существует постоянный обмен метаболитами (см. внешнее изображение)[17].
Углеродный скелет оксалоацетата из цикла трикарбоновых кислот (протекает в митохондриях) переносится в глиоксисомы в форме аспартата. Там аспартат превращается в оксалоацетат, который конденсируется с ацетил-СоА, образовавшимся при окислении жирных кислот. Образующийся при этом цитрат под действием аконитазы переводится в изоцитрат, который далее распадается на глиоксилат и сукцинат под действием изоцитратлиазы. Сукцинат возвращается в митохондрию, где он вовлекается в цикл трикарбоновых кислот и превращается в малат, который переносится в цитоплазму и под действием цитозольной малатдегидрогеназы окисляется в оксалоацетат. В ходе глюконеогенеза оксалоацетат превращается в гексозы и сахарозу, которые могут доставляться в растущие корни и побег. Таким образом, во всех этих превращениях задействованы 4 различных биохимических процесса: окисление жирных кислот до ацетил-СоА (в глиоксисомах), глиоксилатный цикл (в глиоксисомах), цикл трикарбоновых кислот (в митохондрии) и глюконеогенез (в цитозоле)[17].
Наличие общих метаболитов у этих процессов требует их координированной регуляции. Важнейшим из этих соединений является изоцитрат, служащий «точкой расхождения» глиоксилатного цикла и цикла трикарбоновых кислот. Изоцитратдегидрогеназа регулируется при помощи ковалентных модификаций: специфическая протеинкиназа фосфорилирует её и тем самым инактивирует. Эта инактивация приводит к тому, что изоцитрат не может далее участвовать в цикле трикарбоновых кислот и направляется в глиоксилатный цикл, где он становится предшественником для синтеза глюкозы. Фосфопротеинфосфатаза удаляет фосфорильную группу с изоцитратдегидрогеназы, вновь активируя фермент, и большая часть изоцитрата направляется в цикл трикарбоновых кислот, где из него извлекается энергия. Регуляторные ферментативные активности протеинкиназы и фосфопротеинфосфатазы осуществляются одним полипептидом[17].
Некоторые бактерии, в том числе E. coli, имеют в цитозоле полный набор ферментов гликосилатного цикла и цикла трикарбоновых кислот и поэтому могут расти на ацетате как единственном источнике углерода и энергии. Фосфопротеинфосфатаза, активирующая изоцитратдегидрогеназу, стимулируется промежуточными соединениями цикла трикарбоновых кислот и гликолиза, которые служат индикаторами того, что клетка в достаточной мере обеспечена энергией. Те же метаболиты подавляют протеинкиназную активность этого регуляторного полипептида. Поэтому накопление промежуточных продуктов центральных путей, обеспечивающих клетку энергией, свидетельствующее о нехватке энергии, активирует изоцитратдегидрогеназу. Когда концентрация этих веществ падает, свидетельствуя о достаточном снабжении исходными продуктами цикла трикарбоновых кислот, изоцитратдегидрогеназа инактивируется протеинкиназой[17].
Те же соединения гликолиза и цикла трикарбоновых кислот, которые активируют изоцитратдегидрогеназу, являются аллостерическими ингибиторами изоцитратлиазы. Когда скорость энергетического обмена достаточно высока, чтобы поддерживать концентрацию промежуточных соединений глиоксилатного цикла и цикла трикарбоновых кислот низкой, изоцитратдегидрогеназа инактивирована, а ингибирование изоцитратлиазы прекращается, и изоцитрат вовлекается в глиоксилатный цикл, где он будет использован для биосинтеза углеводов, аминокислот и других клеточных компонентов[17].
Биоинженерия
В настоящее время большой интерес для биоинженеров представляет внедрение в млекопитающих тех метаболических путей, которые у них от природы отсутствуют. Одним из таких путей, которые биоинженеры пробовали внедрить в клетки млекопитающих, был глиоксилатный цикл. Интерес к нему был вызван увеличивающимися объёмами получения овечьей шерсти, для которого необходимо большое количество глюкозы. Если бы удалось внедрить это цикл овцам, то огромные запасы ацетата, имеющиеся в клетках, были бы использованы для получения глюкозы, а это, в свою очередь, позволило бы увеличить объёмы получаемой овечьей шерсти[18].
Из ДНК E. coli были выделены и секвенированы два гена, необходимых для глиоксилатного цикла: AceA, кодирующий изоцитратлиазу, и AceB, кодирующий малатсинтазу[18]. После этого эти гены можно было успешно вставить в ДНК клеток культуры тканей млекопитающих, где они бы транскрибировались и транслировались в соответствующие ферменты без всякого вреда для самой клетки, обеспечивая тем самым возможность протекания глиоксилатного цикла. Однако внедрить таким образом этот путь в трансгенных мышей оказалось непросто. Хотя эти гены и экспрессировались в клетках печени и тонкой кишки, уровень их экспрессии был невысок и нестабилен. Чтобы решить эту проблему, можно было бы слить эти гены с промоторами, чтобы увеличить уровень их экспрессии и сделать её возможной и в таких клетках, как эпителиальные[19].
Однако попытки внедрения цикла в более сложно организованных животных, в частности, овец, не увенчались успехом. Это может говорить о том, что высокий уровень экспрессии генов глиоксилатного цикла привёл бы к губительным последствиям для клетки. Определённую пользу для внедрения глиоксилатного цикла в клетки млекопитающих, возможно, принесло бы терапевтическое клонирование, которые дало бы исследователям возможность проверить функциональную интеграцию генов цикла в геноме до внедрения непосредственно в организм[18].
Примечания
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — С. 128. — 384 с. — ISBN 978-5-7695-7979-0.
- Kondrashov F. A., Koonin E. V., Morgunov I. G., Finogenova T. V., Kondrashova M. N. Evolution of glyoxylate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation. (англ.) // Biology direct. — 2006. — Vol. 1. — P. 31. — doi:10.1186/1745-6150-1-31. — PMID 17059607.
- Lorenz M. C., Fink G. R. Life and death in a macrophage: role of the glyoxylate cycle in virulence. (англ.) // Eukaryotic cell. — 2002. — Vol. 1, no. 5. — P. 657—662. — PMID 12455685.
- Popov E. A., Moskalev E. A., Shevchenko M. U., Eprintsev A. T. Comparative analysis of glyoxylate cycle key enzyme isocitrate lyase from organisms of different systematic groups // Journal of Evolutionary Biochemistry and Physiology. — 2005. — Vol. 41, № 6. — P. 631–639. — doi:10.1007/s10893-006-0004-3.
- Bryan A. Wilson, Jonathan C. Schisler, Monte S. Willis. Sir Hans Adolf Krebs: Architect of Metabolic Cycles // LabMedicine. — 2010. — Т. 41. — С. 377—380. — doi:10.1309/LMZ5ZLAC85GFMGHU. (недоступная ссылка)
- Nelson, Cox, 2008, p. 638.
- Хелдт, 2011, с. 315.
- Lorenz M. C., Fink G. R. The glyoxylate cycle is required for fungal virulence. (англ.) // Nature. — 2001. — Vol. 412, no. 6842. — P. 83—86. — doi:10.1038/35083594. — PMID 11452311.
- Kunze M., Pracharoenwattana I., Smith S. M., Hartig A. A central role for the peroxisomal membrane in glyoxylate cycle function. (англ.) // Biochimica et biophysica acta. — 2006. — Vol. 1763, no. 12. — P. 1441—1452. — doi:10.1016/j.bbamcr.2006.09.009. — PMID 17055076.
- Глиоксилатный цикл — статья из Биологического энциклопедического словаря
- Davis W. L., Goodman D. B. Evidence for the glyoxylate cycle in human liver. (англ.) // The Anatomical record. — 1992. — Vol. 234, no. 4. — P. 461—468. — doi:10.1002/ar.1092340402. — PMID 1456449.
- Davis W. L., Jones R. G., Farmer G. R., Dickerson T., Cortinas E., Cooper O. J., Crawford L., Goodman D. B. Identification of glyoxylate cycle enzymes in chick liver--the effect of vitamin D3: cytochemistry and biochemistry. (англ.) // The Anatomical record. — 1990. — Vol. 227, no. 3. — P. 271—284. — doi:10.1002/ar.1092270302. — PMID 2164796.
- Storrey, Kenneth. Functional Metabolism: Regulation and Adaption (англ.). — Hobocken, New Jersey: John Wiley and Sons, Inc., 2004. — P. 221—223. — ISBN 0-471-41090-X.
- Davis W. L., Goodman D. B., Crawford L. A., Cooper O. J., Matthews J. L. Hibernation activates glyoxylate cycle and gluconeogenesis in black bear brown adipose tissue. (англ.) // Biochimica et biophysica acta. — 1990. — Vol. 1051, no. 3. — P. 276—278. — PMID 2310778.
- Jones J. D., Burnett P., Zollman P. The glyoxylate cycle: does it function in the dormant or active bear? (англ.) // Comparative biochemistry and physiology. Part B, Biochemistry & molecular biology. — 1999. — Vol. 124, no. 2. — P. 177—179. — PMID 10584301.
- Davis W. L., Jones R. G., Farmer G. R., Cortinas E., Matthews J. L., Goodman D. B. The glyoxylate cycle in rat epiphyseal cartilage: the effect of vitamin-D3 on the activity of the enzymes isocitrate lyase and malate synthase. (англ.) // Bone. — 1989. — Vol. 10, no. 3. — P. 201—206. — PMID 2553083.
- Nelson, Cox, 2008, p. 639.
- Ward K. A. Transgene-mediated modifications to animal biochemistry. (англ.) // Trends in biotechnology. — 2000. — Vol. 18, no. 3. — P. 99—102. — PMID 10675896.
- Ward K. A., Nancarrow C. D. The genetic engineering of production traits in domestic animals. (англ.) // Experientia. — 1991. — Vol. 47, no. 9. — P. 913—922. — PMID 1915775.
Литература
- Хелдт Г.—В. Биохимия растений. — М.: Бином. Лаборатория знаний, 2011. — 463 с. — ISBN 978-5-94774-795-5.
- David L. Nelson, Michael M. Cox. Lehninger Principles of biochemistry. — Fifth edition. — New York: W. H. Freeman and company, 2008. — 1158 p. — ISBN 978-0-7167-7108-1.
