Гидрид лития
Гидрид лития — неорганическое бинарное соединение щелочного металла лития и водорода. В расплавленном состоянии восстанавливает оксиды металлов и неметаллов. Под действием рентгеновского и ультрафиолетового излучения окрашивается в голубой цвет. Также возможен дейтерид лития с формулой LiD, применяемый в качестве горючего в термоядерных бомбах
| Гидрид лития | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
гидрид лития |
| Традиционные названия | гидрид лития, водородистый литий |
| Хим. формула | LiH |
| Рац. формула | LiH |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 7,95 г/моль |
| Плотность | 0,82 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 692 °C |
| Энтальпия | |
| • образования | -90,7 кДж/моль |
| • плавления | −21,8 кДж/моль |
| Удельная теплота плавления | 21,8 Дж/кг |
| Давление пара | 0 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | реагирует с водой |
| Классификация | |
| Рег. номер CAS | 7580-67-8 |
| PubChem | 62714 |
| Рег. номер EINECS | 231-484-3 |
| SMILES | |
| InChI | |
| RTECS | OJ6300000 |
| ChemSpider | 56460 |
| Безопасность | |
| Предельная концентрация | 0,1 мг/м³ |
| ЛД50 | 100-143 мг/кг |
| Токсичность | высокая |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
Гидрид лития получают реакцией синтеза непосредственно из элементов лития и водорода:
или восстановлением нитрида лития водородом:
Физические свойства
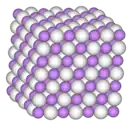
Белый, лёгкий порошок, плавится без разложения в инертной атмосфере. Образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, параметры ячейки a = 0,4083 нм, Z = 4, структура типа NaCl.
Под действием излучения от видимого до рентгеновского кристаллы окрашиваются в интенсивный голубой цвет из-за образования твёрдого коллоидного раствора металлического лития в гидриде лития.
Слабо растворим в диэтиловом эфире.
Химические свойства
Гидрид лития относительно устойчив в сухом воздухе. Парами воды быстро гидролизуется (с водой реакция идёт бурно, возможно самовоспламенение):
При нагревании выше 850°С (а в вакууме до 450°С) начинает распадаться на элементы:
Электролизом расплава также можно разложить гидрид лития на элементы, при этом водород выделяется на аноде, т.е. в расплаве происходит электролитическая диссоциация:
С кислородом и азотом начинает взаимодействовать только при нагревании и результат зависит от температуры:
Реагирует с другими неметаллами (C, P, S, Si):
Восстанавливает оксиды металлов и неметаллов:
Может образовывать двойные гидриды:
Применение
Используется как осушитель, как сырье для производства алюмогидрида лития (сильный восстановитель, используемый в органическом синтезе), как замедлитель в радиационных защитах ядерных реакторов. Также гидрид лития используется как легкий и портативный источник водорода для аэростатов и спасательного снаряжения.
Дейтерид лития-6
Дейтерид лития-6 6LiD (или 6Li2H) используется как термоядерное топливо в термоядерном оружии.
Безопасность
Вещество токсично. ПДК 0,03 мг/дм³. При контакте с кожей и слизистыми оболочками (в чистом виде) гидрид лития может вызвать химический ожог.
ЛД50 на белых мышах — 140—143 мг/кг.
Имелись также данные о том, что гидрид лития является генетическим ядом, а также — антагонистом ионов натрия, которые, в свою очередь и являются обязательным макроэлементом для живых организмов.
См.также
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
