Гемэритрин
Гемэритри́н (от др.-греч. αἷμα — кровь и др.-греч. ερυθρός — красный) — олигомерный железосодержащий белок класса металлопротеинов, обнаруженный в крови некоторых беспозвоночных животных. Способный обратимо связываться с кислородом, обеспечивая его перенос в ткани[1]. Гемэритрин используется для транспорта кислорода в крови плеченогих, сипункулид, приапулид, некоторых кольчатых червей (полихет). Кроме того, гемэритрин обнаружен у метанотрофной бактерии Methylococcus capsulatus. Миогемэритрин — аналог миоглобина позвоночных, обнаруживается в мышцах некоторых морских беспозвоночных.
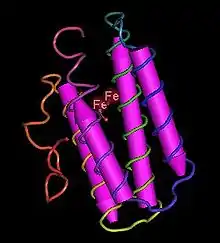
Строение
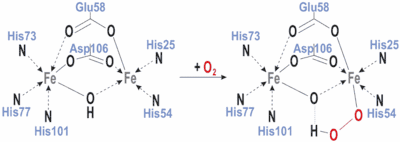
Активный центр гемэритрина содержит два катиона Fe, соединённых между собой гидроксильной группой[1][2]. Ионы железа также координированы атомами азота имидазольных циклов гистидиновых остатков и карбоксильными группами глутаминовой и аспаргиновой кислот[2]. В неоксигенированной форме один из ионов железа имеет координационное число 5, а другой – 6. В оксигенированной форме оба иона приобретают координационное число 6. В неоксигенированной форме катионы Fe имеют степень окисления +2, в оксигенированной +3[2].
Насыщенный кислородом гемэритрин придаёт крови фиолетовый оттенок, ненасыщенный — светло-розовый. Может содержаться как в плазме, так и в специализированных клетках, получивших название розовых кровяных телец.
Молекула гемэритрина, как правило, является октамером, то есть состоит из восьми субъединиц, представленных полипептидными цепями α- и β-типов. У некоторых видов гемэритрин может быть представлен в виде димера, тримера или тетрамера. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат только α-спирали[1].
Гемэритрин связывает кислород прочнее, чем гемоглобин или миоглобин. Поэтому он часто встречается у животных, способных подолгу находиться в анаэробных условиях. Кроме того, гемэритрин, в отличие от гемоглобина, практически не связывается с монооксидом углерода (CO), что предохраняет организмы, использующие гемэритрин, от отравления угарным газом[1]. Однако, надо заметить, что гемэритрину в меньшей степени свойственна кооперативность при связывании кислорода[1].
Примечания
- Ronald Eugene Stenkamp. Dioxygen and Hemerythrin (англ.) // Chem. Rev.. — 1994. — Vol. 94, no. 3. — P. 715—726.
- Wirstam M, Lippard SJ, Friesner RA. Reversible dioxygen binding to hemerythrin (англ.) // J Am Chem Soc. — 2003. — Vol. 125, no. 13. — P. 3980—3987.
Литература
- Алякринская И. О. Гемоглобины и гемоцианины беспозвоночных. — Москва: Наука, 1979. — 155 с.
- Яценко А. В. Комплексные соединения в процессах дыхания живых существ.
- Топунов А. Ф., Петрова Н. Э. Гемоглобины: эволюция, распространение и гетерогенность // Успехи биологической химии. — Москва: Институт биохимии им. А. Н. Баха РАН, 2001. — Т. 41. — С. 199—228. Архивировано 24 октября 2009 года.
- Космачевская О. В., Топунов А. Ф. Гемоглобины: единство в многообразии // Химия и жизнь. — 2007. — № 10. — С. 28—33.
- Житенева Л. Д., Макаров Э. В., Рудницкая О. В. Эволюция крови. — Ростов-на-Дону: Азовский научно-исследовательский институт рыбного хозяйства (АзНИИРХ), 2001. — 104 с.
Ссылки
- 1HMD Архивная копия от 1 февраля 2008 на Wayback Machine — строение деокси-формы гемэритрина сипункулиды Themiste dyscrita на PDB
- 1HMO Архивная копия от 1 февраля 2008 на Wayback Machine — строение оксигенированной формы гемэритрина Themiste dyscrita на PDB
- 2MHR Архивная копия от 1 февраля 2008 на Wayback Machine — строение азидо-мет-миогемэритрина Themiste zostericola на PDB
- IPR002063 — описание на InterPro