Бромодомен
Бромодомен — высококонсервативный белковый домен размером около 110 аминокислотных остатков, специфично связывающий ε-аминоацетильные группы остатков лизина в белках. Бромодомен состоит из 4 α-спиралей, уложенных в левозакрученный пучок. Узнавание ацетиллизина происходит за счёт двух консервативных петель — ZA и BC[1].
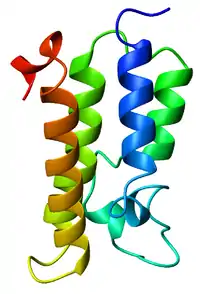
По предварительным оценкам, геном человека кодирует 61 бромодомен в 46 белках[2]. Бромодомены обнаружены у членов суперсемейства ДНК-хеликаз, а также в белках, принимающих участие в модификациях гистонов и ремоделировании хроматина, например в гистонацетилтрансферазах[1].
Известны белки млекопитающих, которые содержат сдвоенные бромодомены: это белки семейства BET (англ. bromodomain and extra-terminal domain) BRD2, BRD3 и BRD4. У дрожжей и растений белки с двумя бромодоменами пока не обнаружены[1].
Примечания
- Belkina A. C., Denis G. V. BET domain co-regulators in obesity, inflammation and cancer. (англ.) // Nature reviews. Cancer. — 2012. — Vol. 12, no. 7. — P. 465—477. — doi:10.1038/nrc3256. — PMID 22722403.
- Filippakopoulos P., Picaud S., Mangos M., Keates T., Lambert J. P., Barsyte-Lovejoy D., Felletar I., Volkmer R., Müller S., Pawson T., Gingras A. C., Arrowsmith C. H., Knapp S. Histone recognition and large-scale structural analysis of the human bromodomain family. (англ.) // Cell. — 2012. — Vol. 149, no. 1. — P. 214—231. — doi:10.1016/j.cell.2012.02.013. — PMID 22464331.