Duplodnaviria
Duplodnaviria (лат.) — реалм[Ком. 1] ДНК-содержащих вирусов, на март 2020 года включающий единственное царство Heunggongvirae[2]. Выделение данного реалма было предложено в 2019 году.
| Duplodnaviria | ||||||
|---|---|---|---|---|---|---|
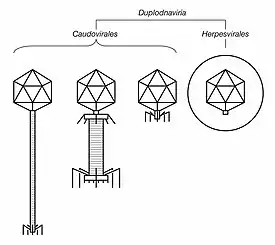 Морфология вирионов Duplodnaviria | ||||||
| Научная классификация | ||||||
| Международное научное название | ||||||
| Duplodnaviria | ||||||
| Группа по Балтимору | ||||||
| I: дцДНК-вирусы | ||||||
| ||||||
Геном Duplodnaviria представлен двуцепочечной молекулой ДНК. Основанием для выделения этого реалма послужило наличие у включаемых в него таксонов белков HK97-MCP (где MCP (от англ. major capsid protein) — основной белок капсида), которые упаковывают вирусную ДНК. Членов реалма объединяют и некоторые другие черты, такие как икосаэдрический капсид, наличие портальной поры в капсиде, протеаза, которая разрушает белковый скаффолд капсида перед загрузкой в него вирусной ДНК, а также терминаза — фермент, упаковывающий вирусную ДНК в капсид. В составе реалма Duplodnaviria выделяют две основные группы вирусов: имеющие «хвост» бактериофаги (порядок Caudovirales) и вирусы эукариот, относящиеся к порядку Herpesvirales.
Этимология
Название таксона произведено от лат. dūplō, что означает «двойной» (отсылка к двуцепочечной ДНК), DNA — ДНК и стандартного для всех реалмов суффикса -viria[3]. Название единственного царства в составе реалма, Heunggongvirae, образовано от название его представителя — фага Escherichia virus HK97, который получил свое название от Hong Kong 97, так как впервые его обнаружили в Гонконге. Именно в основном белке капсида этого вируса была впервые обнаружена характерная укладка, которая присутствует в MCP всех членов царства[4].
Характеристика
Все представители Duplodnaviria имеют характерный икосаэдрический капсид, сформированный основным белком капсида (MCP), в составе которого имеется характерная укладка, впервые найденная у бактериофага Escherichia virus HK97. Хотя структура MCP у разных представителей Duplodnaviria сильно различается, её «каркас» сохраняется у всех членов реалма. Помимо MCP, в состав капсида у Duplodnaviria входит портальный белок, образующий пору капсида, протеаза, расщепляющая белки внутри капсида (белковый скаффолд, необходимый для его сборки) перед загрузкой геномной ДНК, и терминаза, которая загружает ДНК в капсид[5][4][6].
После того, как рибосомы клетки синтезировали достаточное количество белка HK97-MCP, его молекулы начинают собираться в капсид. В сборке капсида участвуют белки скаффолда, которые направляют сборку и оказываются внутри новообразованного капсида. В отсутствие скаффолд-белков роль направляющего белка капсида играет дельта-домен HK97-MCP, повёрнутый внутрь капсида[5][6][7]. Перед загрузкой ДНК в капсид белки скаффолда расщепляются специальной протеазой, освобождая пространство внутри капсида. Цилиндрическая пора в капсиде (портал) нужна для входа в капсид и выхода из него вирусной ДНК. Портал находится на одной из двенадцати вершин икосаэдрического капсида[6][7].
Параллельно сборке капсидов в заражённой клетке происходит репликация вирусной ДНК, в результате которой образуются конкатемеры — длинные молекулы, состоящие из множества одинаковых копий вирусного генома, примыкающих друг к другу. Внутри клетки вирусную ДНК распознает вирусный фермент терминаза, имеющий две субъединицы — большую и малую (именно малая субъединица распознает вирусную ДНК). Терминаза, связанная с конкатемером, прикрепляется к портальной поре капсида и начинает упаковывать ДНК в капсид, при этом разрезая конкатемер на отдельные геномы со свободными концами. Загрузка ДНК в капсид происходит за счёт энергии АТФ, который гидролизует большая субъединица терминазы. По мере загрузки ДНК в капсид увеличивается в объёме, становится тоньше, его поверхность уплощается, углы заостряются. Когда геном загружен в капсид, терминаза вносит разрез в конкатемер и открепляется от портальной поры, завершая загрузку. У «хвостатых» фагов хвост собирается отдельно от головки капсида и присоединяется к ней в районе портальной поры. Иногда у хвостатых фагов имеются дополнительные «декорирующие» белки, укрепляющие капсид. По завершении сборки капсида он покидает клетку. Хвостатые фаги вызывают лизис и смерть клетки-хозяина[8], а у герпесвирусов новые вирионы выходят из клетки при помощи отпочковывания от клеточной мембраны, поэтому их капсиды покрыты сверху липидным бислоем (суперкапсид)[9][6][7].
Филогенетика
Хвостатые фаги, возможно, являются древнейшими из ныне существующих вирусов, поскольку они распространены повсеместно, поражают только прокариот и отличаются высоким генетическим разнообразием. Происхождение Herpesvirales точно не установлено, однако предложены два вероятных сценария их появления. Согласно первому из них, от фагов порядка Caudovirales несколько раз эволюционировали группы вирусов, способные инфицировать эукариот, а сходство между современными Herpesvirales и Caudovirales может свидетельствовать, что Herpesvirales — это группа вирусов эукариот, наиболее недавно обособившаяся от Caudovirales. Согласно второму сценарию, Herpesvirales являются дочерней кладой Caudovirales, что подтверждается близким генетическим сходством фагов порядка Caudovirales семейства Myoviridae подсемейства Tevenvirinae[10]. Предполагается, что вирусы реалма Duplodnaviria поражали последнего универсального общего предка (LUCA)[11].
Вне вирусов реалма Duplodnaviria укладка HK97 встречается только у бактериальных белков семейства инкапсулинов, которые формируют нанокомпартменты, содержащие белки, связанные с окислительным стрессом. Инкапсулины формируют икосаэдрические белковые компартменты, похожие на капсиды вирусов Duplodnaviria. Но MCP-HK97, по сравнению с инкапсулинами, распространены гораздо шире и сильно отличаются друг от друга, а инкапсулины формируют узкую монофилетическую кладу. По этой причине происхождение инкапсулинов от MCP-HK97 более вероятно, чем происхождение MCP-HK97 от инкапсулинов. Этой гипотезе, однако, противоречит тот факт, что инкапсулины имеются у архей типа Crenarchaeota, которые не заражаются хвостатыми фагами, поэтому связь инкапсулинов и MCP-HK97 остаётся неоднозначной[12].
АТФазная субъединица терминазы вирусов Duplodnaviria имеет такую же принципиальную структуру укладки типа P-петля, что и упаковывающие АТФазы вирусов реалма Varidnaviria, содержащие укладку double jelly roll. Однако на этом сходство между вирусами двух реалмов заканчивается: Duplodnaviria используют укладку HK97 в составе MCP, а MCP Varidnaviria содержат укладки типа jelly roll[4].
Классификация
На март 2020 года к реалму относят следующие таксоны до порядка включительно[2]:
- Царство Heunggongvirae
- Тип Peploviricota
- Класс Herviviricetes
- Порядок Herpesvirales
- Класс Herviviricetes
- Тип Uroviricota
- Класс Caudoviricetes
- Порядок Caudovirales
- Класс Caudoviricetes
- Тип Peploviricota
Взаимодействие с хозяином
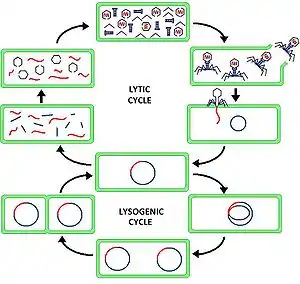
Хвостатые фаги распространены повсеместно и являются основной причиной гибели прокариотической клетки. Смерть клетки может наступить в результате лизиса, запускаемого фагом, при котором происходит нарушение целостности клеточной мембраны (литический цикл), что вносит большой вклад в вирусный шунт. Хвостатые фаги шунтируют органические вещества с высших трофических уровней на низшие трофические уровни, что играет важную роль в круговороте питательных веществ и стимулирует появление биологического разнообразия среди морских организмов[13]. Нередко хвостатые фаги не убивают клетку мгновенно, а встраиваются в её геном и длительное время находятся в латентном состоянии (лизогенный цикл)[14][15].
Герпесвирусы вызывают многие заболевания человека и животных, например, дыхательную и репродуктивную недостаточность у крупного рогатого скота[16] и фибропаппиломатоз морских черепах[17], у человека — ветряную оспу[18], опоясывающий лишай[19], саркому Капоши[20].
История изучения
Хвостатые фаги были открыты независимо Фредериком Туортом в 1915 году и Феликсом Д’Эррелем в 1917 году[21]. Заболевания человека, вызываемые герпесвирусами, известны на протяжении большей части документированной истории, а передача от человека к человеку вируса простого герпеса, первого открытого герпесвируса, была описана Эмилем Видалем в 1893 году[22].
За годы изучения было накоплено много свидетельств близкого сходства икосаэдрических фагов и герпесвирусов, и в 2019 году на основании данных генетического анализа вирусы были объединены в реалм Duplodnaviria. В том же году в составе реалма были выделены царство, тип и классы, однако последние исследования разнообразия Caudovirales показали, что хвостатые фаги заслуживают ранга класса или более высокого ранга[4].
Примечания
Комментарии
- На данный момент устоявшегося русскоязычного термина, соответствующего англ. realm в таксономии, нет.
Источники
- Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Дата обращения: 27 апреля 2020).
- Eugene V Koonin, Valerian V. DoljaMart, Mart Krupovic, Arvind Varsani, Yuri I Wolf, Natalya Yutin, Francisco Murilo Zerbini, Jens H. Kuhn. Create a megataxonomic framework, filling all principal/primary taxonomic ranks, for dsDNA viruses encoding HK97-type major capsid proteins. — 2019. — doi:10.13140/RG.2.2.16564.19842.
- Koonin EV, Dolja VV, Krupovic M, Varsani A, Wolf YI, Yutin N, Zerbini M, Kuhn JH. Create a megataxonomic framework, filling all principal/primary taxonomic ranks, for dsDNA viruses encoding HK97-type major capsid proteins (англ.) (docx). International Committee on Taxonomy of Viruses (18 октября 2019). Дата обращения: 19 мая 2020.
- Suhanovsky M. M., Teschke C. M. Nature's favorite building block: Deciphering folding and capsid assembly of proteins with the HK97-fold. (англ.) // Virology. — 2015. — May (vol. 479-480). — P. 487—497. — doi:10.1016/j.virol.2015.02.055. — PMID 25864106.
- Rao V. B., Feiss M. Mechanisms of DNA Packaging by Large Double-Stranded DNA Viruses. (англ.) // Annual Review Of Virology. — 2015. — November (vol. 2, no. 1). — P. 351—378. — doi:10.1146/annurev-virology-100114-055212. — PMID 26958920.
- Duda R. L., Oh B., Hendrix R. W. Functional domains of the HK97 capsid maturation protease and the mechanisms of protein encapsidation. (англ.) // Journal Of Molecular Biology. — 2013. — 9 August (vol. 425, no. 15). — P. 2765—2781. — doi:10.1016/j.jmb.2013.05.002. — PMID 23688818.
- Myoviridae (англ.). ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 19 мая 2020.
- Herpesviridae (англ.). ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 19 мая 2020.
- Andrade-Martínez J. S., Moreno-Gallego J. L., Reyes A. Defining a Core Genome for the Herpesvirales and Exploring their Evolutionary Relationship with the Caudovirales. (англ.) // Scientific Reports. — 2019. — 5 August (vol. 9, no. 1). — P. 11342—11342. — doi:10.1038/s41598-019-47742-z. — PMID 31383901.
- Krupovic M., Dolja V. V., Koonin E. V. The LUCA and its complex virome. (англ.) // Nature Reviews. Microbiology. — 2020. — 14 July. — doi:10.1038/s41579-020-0408-x. — PMID 32665595.
- Krupovic M., Koonin E. V. Multiple origins of viral capsid proteins from cellular ancestors. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2017. — 21 March (vol. 114, no. 12). — P. 2401—2410. — doi:10.1073/pnas.1621061114. — PMID 28265094.
- Wilhelm S. W., Suttle C. A. Viruses and Nutrient Cycles in the Sea: Viruses play critical roles in the structure and function of aquatic food webs (англ.) // BioScience : journal. — 1999. — October (vol. 49, no. 10). — P. 781—788. — doi:10.2307/1313569. — .
- Weidner-Glunde M., Kruminis-Kaszkiel E., Savanagouder M. Herpesviral Latency-Common Themes. (англ.) // Pathogens (Basel, Switzerland). — 2020. — 15 February (vol. 9, no. 2). — doi:10.3390/pathogens9020125. — PMID 32075270.
- Virus latency (англ.). ViralZone. Swiss Institute of Bioinformatics. Дата обращения: 15 июня 2020.
- Graham D. A. Bovine herpes virus-1 (BoHV-1) in cattle-a review with emphasis on reproductive impacts and the emergence of infection in Ireland and the United Kingdom. (англ.) // Irish Veterinary Journal. — 2013. — 1 August (vol. 66, no. 1). — P. 15—15. — doi:10.1186/2046-0481-66-15. — PMID 23916092.
- Jones K., Ariel E., Burgess G., Read M. A review of fibropapillomatosis in Green turtles (Chelonia mydas). (англ.) // Veterinary Journal (London, England : 1997). — 2016. — June (vol. 212). — P. 48—57. — doi:10.1016/j.tvjl.2015.10.041. — PMID 27256025.
- Chickenpox (Varicella) Overview (недоступная ссылка). cdc.gov (16 ноября 2011). Дата обращения: 4 февраля 2015. Архивировано 4 февраля 2015 года.
- Steiner I., Kennedy P. G., Pachner A. R. The neurotropic herpes viruses: herpes simplex and varicella-zoster. (англ.) // The Lancet. Neurology. — 2007. — November (vol. 6, no. 11). — P. 1015—1028. — doi:10.1016/S1474-4422(07)70267-3. — PMID 17945155.
- Kaposi Sarcoma Treatment (англ.). National Cancer Institute (16 июня 2017).
- Keen E. C. A century of phage research: bacteriophages and the shaping of modern biology. (англ.) // BioEssays : News And Reviews In Molecular, Cellular And Developmental Biology. — 2015. — January (vol. 37, no. 1). — P. 6—9. — doi:10.1002/bies.201400152. — PMID 25521633.
- Hunt R. D. Herpesviruses of Primates: An Introduction. In: Jones T.C., Mohr U., Hunt R.D. (eds) Nonhuman Primates I (англ.). — Springer, Berlin, Heidelberg, 1993. — P. 74—78. — ISBN 978-3-642-84906-0. — doi:10.1007/978-3-642-84906-0_11.