D-димер
D-димер — это продукт распада фибрина, небольшой фрагмент белка, присутствующий в крови после разрушения тромба (процесс фибринолиза). Он называется «димер», так как содержит два соединяющихся D фрагмента белка фибриногена.[1]
Для диагностики тромбоза можно определить концентрацию D-димеров в крови — тест на D-димеры. С момента своего появления в 1990-х годах тест на D-димеры стал важным исследованием для пациентов с подозрением на тромботические нарушения. В то время как отрицательный результат практически исключает тромбоз, положительный результат может быть вызван как тромбозом, так и другими возможными причинами. Его главная польза, таким образом, — исключение тромбоэмболии. Кроме того, он используется в диагностике ДВС-синдрома (синдром внутрисосудистого свертывания)[1] и нарушений свертывания крови, связанных с инфекцией COVID-19.[2][3] Четырехкратное увеличение белка является показателем плохого прогноза у людей, госпитализированных с COVID-19.[2][3][4]
Принципы
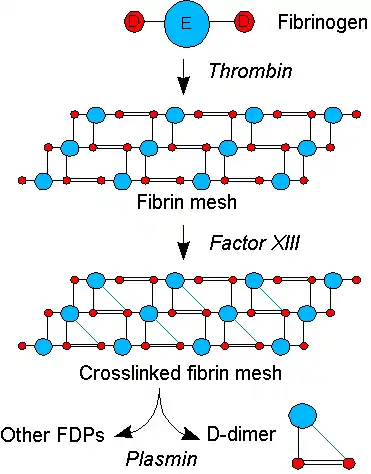
Коагуляция — образование свёртка крови или тромба — начинается при активации белков свертывания: либо при контакте с поврежденной стенкой кровеносного сосуда («внешний путь» свертывания), либо под влиянием факторов свертывания, содержащихся в плазме крови («внутренний путь» свертывания). Оба пути активации приводят к генерации тромбина — фермента, который преобразует растворимый белок крови фибриноген в фибрин, в свою очередь фибрин образует фибриновое волокно. Другой фермент, генерируемый тромбином, фактор XIII, затем сшивает фибриновое волокно поперечными соединениями, что приводит к образованию нерастворимого геля, служащего каркасом для образования сгустка крови.[1]
Циркулирующий в крови энзим плазмин, основной фермент фибринолиза, расщепляет фибриновый гель в нескольких местах. Полученные фрагменты «высокомолекулярных полимеров» расщепляются плазмином ещё несколько раз и оставляют после себя промежуточные, а затем малые полимеры (продукты распада фибрина). Однако, поперечные связи между двумя D фрагментами остаются неизменными. Типичный фрагмент, содержащий D-димер, состоит из двух доменов D и одного домена E от оригинальной молекулы фибриногена.[1]
D-димеры обычно не присутствуют в плазме крови человека, кроме случаев, когда свертывающая система была активирована, например в случае состоявшегося тромбоза или ДВС-синдрома. Анализ на D-димеры зависит от связывания моноклональных антител с конкретным эпитопом на фрагменте D-димера. Для коммерческого использования существует несколько различных анализаторов на D-димеры, использующих различные моноклональные антитела к D-димеру. Для некоторых из них расстояние до D-димера, на котором возможно связывание с моноклональным антителом, известно. Связывание антитела затем измеряется количественно с помощью одной из различных лабораторных методик.[1]
Показания
Анализ на D-димеры показан при подозрениях на тромбоз глубоких вен (ТГВ), легочную эмболию (ТЭЛА) или ДВС-синдром.[5] Изучается возможность диагностики расслоения аорты.[6][7] Для ТГВ и ТЭЛА существуют различные системы расчета, которые используются для определения «априорной» клинической вероятности этих заболеваний; самые известные были введены Wells и другими (2003).
- при наличии или вероятности серьезных клинических показаний, уровень D-димеров будет иметь незначительное влияние, и начинать антикоагулянтную терапию надо независимо от результатов теста. В случае тромбоза глубоких вен или ТЭЛА могут быть выполнены дополнительные исследования.
- при невысоких и средних клинических показаниях или вероятности:[8]
- отрицательный уровень D-димера в крови практически исключает тромбоэмболию: уровень, до которого тест на D-димеры уменьшает вероятность тромботических нарушений, зависит от особенностей конкретного теста, использовавшегося в клинических условиях: самый распространенный тест на D-димеры при отрицательном результате говорит о вероятности тромбоэмболии менее 1 %, тогда как вероятность предварительной оценки составляет меньше 15-20 %.
- Если D-димеры показывают высокий результат, то дальше для подтверждения наличия тромба проводят ультразвуковые исследования вен ног (ультрасонография) или легких (сцинтиграфия). В зависимости от клинической ситуации, антикоагулянтную терапию можно начать сразу или же после проведения дополнительных исследований.
В некоторых клиниках лабораторные исследования проводят после того, как будет заполнена форма, показывающая оценочную величину, и только в том случае, если эта оценочная величина низкая или средняя. Это уменьшает количество ненужных исследований для пациентов с высокой вероятностью ТГВ и ТЭЛА.[9] Выполнение теста на D-димеры в первую очередь позволяет избежать большого числа визуальных исследований, а также является менее инвазивным. Поэтому тест на D-димеры рекомендуется в качестве первоначальной диагностики.[10][11][12][13]
Характеристики теста
Различные лабораторные анализаторы имеют чувствительность в диапазоне 93-95 % и специфичность приблизительно 50 % при диагностике тромботических заболеваний.[14]
- Ложноположительный результат возможен в следующих случаях: болезни печени, высокий ревматоидный фактор, воспаление, онкологическое заболевание, травма, беременность, недавно перенесенное хирургическое вмешательство.
- Ложноотрицательный результат встречается в случаях, если анализ взят слишком быстро после формирования тромба, либо наоборот, по прошествии нескольких дней. Кроме того, присутствие антикоагулянтов может приводить к отрицательному результату, так как они препятствуют росту тромба.
- Ложные показания могут наблюдаться в случаях, если объём образца для анализа меньше или больше требуемого. Это наблюдается вследствие дилюционного эффекта антикоагулянтов (образец крови необходимо разбавлять антикоагулянтом в соотношении 9:1)
- Отношение правдоподобия определяется чувствительностью и специфичностью, соотнесенными с предварительной вероятностью.
При интерпретации теста на D-димеры для пациентов старше 50 лет величина, равная возрасту x10, является патологической.[15][16]
История
D-димер был впервые описан в 1970-е годы, а его диагностическое применение было найдено в 1990-е.[1]
См. также
- Тромбоэластография
- Тест генерации тромбина (тромбиновый потенциал, эндогенный тромбиновый потенциал)
- Тромбодинамика
- Тест протромбинового времени (или Протромбиновый тест, МНО, ПВ)
- Активированное частичное тромбопластиновое время (АЧТВ)
Ссылки
- Adam S. S., Key N. S., Greenberg C. S. D-dimer antigen: current concepts and future prospects. (англ.) // Blood. — 2009. — Vol. 113, no. 13. — P. 2878—2887. — doi:10.1182/blood-2008-06-165845. — PMID 19008457.
- Asakura, Hidesaku; Ogawa, Haruhiko (2020). “COVID-19-associated coagulopathy and disseminated intravascular coagulation”. International Journal of Hematology. 113 (1): 45—57. DOI:10.1007/s12185-020-03029-y. ISSN 0925-5710. PMC 7648664. PMID 33161508.
- Ponti, G; Maccaferri, M; Ruini, C; Tomasi, A; Ozben, T (2020). “Biomarkers associated with COVID-19 disease progression”. Critical Reviews in Clinical Laboratory Sciences. 57 (6): 389—399. DOI:10.1080/10408363.2020.1770685. ISSN 1040-8363. PMC 7284147. PMID 32503382.
- Velavan, Thirumalaisamy P.; Meyer, Christian G. (25 April 2020). “Mild versus severe COVID-19: laboratory markers”. International Journal of Infectious Diseases. 95: 304—307. DOI:10.1016/j.ijid.2020.04.061. PMID 32344011. Дата обращения 25 April 2020.
- General Practice Notebook > D-dimer Архивная копия от 30 января 2019 на Wayback Machine Retrieved September 2011
- Suzuki T., Distante A., Eagle K. Biomarker-assisted diagnosis of acute aortic dissection: how far we have come and what to expect. (англ.) // Current opinion in cardiology. — 2010. — Vol. 25, no. 6. — P. 541—545. — doi:10.1097/HCO.0b013e32833e6e13. — PMID 20717014.
- Ranasinghe A. M., Bonser R. S. Biomarkers in acute aortic dissection and other aortic syndromes. (англ.) // Journal of the American College of Cardiology. — 2010. — Vol. 56, no. 19. — P. 1535—1541. — doi:10.1016/j.jacc.2010.01.076. — PMID 21029872.
- Wells P. S., Anderson D. R., Rodger M., Forgie M., Kearon C., Dreyer J., Kovacs G., Mitchell M., Lewandowski B., Kovacs M. J. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis. (англ.) // The New England journal of medicine. — 2003. — Vol. 349, no. 13. — P. 1227—1235. — doi:10.1056/NEJMoa023153. — PMID 14507948.
- Rathbun S. W., Whitsett T. L., Vesely S. K., Raskob G. E. Clinical utility of D-dimer in patients with suspected pulmonary embolism and nondiagnostic lung scans or negative CT findings. (англ.) // Chest. — 2004. — Vol. 125, no. 3. — P. 851—855. — PMID 15006941.
- American College of Physicians, Five Things Physicians and Patients Should Question, American College of Physicians, <http://choosingwisely.org/wp-content/uploads/2012/04/5things_12_factsheet_Amer_College_Phys.pdf>. Проверено 14 августа 2012. Архивированная копия (недоступная ссылка). Дата обращения: 29 ноября 2012. Архивировано 24 июня 2012 года.
- Fesmire F. M., Brown M. D., Espinosa J. A., Shih R. D., Silvers S. M., Wolf S. J., Decker W. W. Critical issues in the evaluation and management of adult patients presenting to the emergency department with suspected pulmonary embolism. (англ.) // Annals of emergency medicine. — 2011. — Vol. 57, no. 6. — P. 628—652. — doi:10.1016/j.annemergmed.2011.01.020. — PMID 21621092.
- Authors/Task Force Members, Torbicki Adam, Perrier Arnaud, Konstantinides Stavros, Agnelli Giancarlo, Galiè Nazzareno, Pruszczyk Piotr, Bengel Frank, Brady Adrian J.B., Ferreira Daniel, Janssens Uwe, Klepetko Walter, Mayer Eckhard, Remy-Jardin Martine, Bassand Jean-Pierre, Vahanian Alec, Camm John, De Caterina Raffaele, Dean Veronica, Dickstein Kenneth, Filippatos Gerasimos, Funck-Brentano Christian, Hellemans Irene, Kristensen Steen Dalby, McGregor Keith, Sechtem Udo, Silber Sigmund, Tendera Michal, Widimsky Petr, Zamorano Jose Luis, Zamorano Jose-Luis, Andreotti Felicita, Ascherman Michael, Athanassopoulos George, De Sutter Johan, Fitzmaurice David, Forster Tamas, Heras Magda, Jondeau Guillaume, Kjeldsen Keld, Knuuti Juhani, Lang Irene, Lenzen Mattie, Lopez-Sendon Jose, Nihoyannopoulos Petros, Perez Isla Leopoldo, Schwehr Udo, Torraca Lucia, Vachiery Jean-Luc. Guidelines on the diagnosis and management of acute pulmonary embolism // European Heart Journal. — 2008. — 1 сентября (т. 29, № 18). — С. 2276—2315. — ISSN 1522-9645. — doi:10.1093/eurheartj/ehn310.
- Qaseem A., Snow V., Barry P., Hornbake E. R., Rodnick J. E., Tobolic T., Ireland B., Segal J., Bass E., Weiss K. B., Green L., Owens D. K., the Joint American Academy of Family Physicians/American College of Physicians Panel on Deep Venous Thrombosis/Pulmonary Embolism. Current Diagnosis of Venous Thromboembolism in Primary Care: A Clinical Practice Guideline from the American Academy of Family Physicians and the American College of Physicians // The Annals of Family Medicine. — 2007. — 1 января (т. 5, № 1). — С. 57—62. — ISSN 1544-1709. — doi:10.1370/afm.667.
- Schrecengost J. E., LeGallo R. D., Boyd J. C., Moons K. G., Gonias S. L., Rose C. E. Jr., Bruns D. E. Comparison of diagnostic accuracies in outpatients and hospitalized patients of D-dimer testing for the evaluation of suspected pulmonary embolism. (англ.) // Clinical chemistry. — 2003. — Vol. 49, no. 9. — P. 1483—1490. — PMID 12928229.
- van Es J., Mos I., Douma R., Erkens P., Durian M., Nizet T., van Houten A., Hofstee H., ten Cate H., Ullmann E., Büller H., Huisman M., Kamphuisen P. W. The combination of four different clinical decision rules and an age-adjusted D-dimer cut-off increases the number of patients in whom acute pulmonary embolism can safely be excluded. (англ.) // Thrombosis and haemostasis. — 2012. — Vol. 107, no. 1. — P. 167—171. — doi:10.1160/TH11-08-0587. — PMID 22072293.
- Douma R. A., le Gal G., Söhne M., Righini M., Kamphuisen P. W., Perrier A., Kruip M. J., Bounameaux H., Büller H. R., Roy P. M. Potential of an age adjusted D-dimer cut-off value to improve the exclusion of pulmonary embolism in older patients: a retrospective analysis of three large cohorts. (англ.) // BMJ (Clinical research ed.). — 2010. — Vol. 340. — P. 1475. — PMID 20354012.