Хлорат кальция
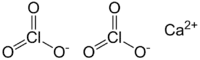
Хлорат кальция — неорганическое соединение кальция, соль хлорноватой кислоты. Вступает в комплексное соединение с водой, образуя дигидрат Ca(ClO3)2(H2O)2, представляющий собой гигроскопичные бесцветные моноклинные кристаллы[1]. Хлорат-хлорид кальция (смесь Ca(ClO3)2 с хлоридом кальция CaCl2) применяется (в частности, на посевах хлопчатника) в виде водного раствора как дефолиант и десикант[2] (гербицид: средство для предуборочного подсушивания растений на корню[3]).
| Хлорат кальция | |
|---|---|
 | |
| Общие | |
| Хим. формула | CaCl2O6 |
| Рац. формула | Ca(ClO3)2 |
| Физические свойства | |
| Молярная масса | 206.98 г/моль |
| Плотность | 2.71 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 325 °C |
| Классификация | |
| Рег. номер CAS | 10017-74-3 |
| PubChem | 24978 |
| Рег. номер EINECS | 233-378-2 |
| SMILES | |
| InChI | |
| RTECS | FN9800000 |
| ChemSpider | 23349 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Производство
В промышленности хлорат кальция получают известковым методом: путём хлорирования известкового молока имеющего концентрацию CaO 130—140 г/л. В начале идёт образование гипохлорита кальция
- ккал.
Затем образующаяся при гидролизе хлора хлорноватистая кислота окисляет гипохлорит в хлорат:
- .
Образующаяся соляная кислота в реакции с гипохлоритом замещает хлорноватистую кислоту
- ,
которая также вступает в реакцию с гипохлоритом. Суммарное уравнение окисления гипохлорита:
- ккал,
а общее уравнение процесса образования хлората кальция:
- ккал.
Оптимальным считается проведение реакции в нейтральной среде (pH 7-7.4) при температуре 45-80°, при которой реакция проходит достаточно быстро, а разложение гипохлорита кальция с потерей кислорода — незначительно. Полученный таким образом хлорат кальция может быть использован для получения хлората калия методом обменного разложения с хлоридом калия.[4]
Хлорат кальция из хлорированного известкового молока может быть получен упариванием или охлаждением. Альтернативный способ получения — обменное разложение хлората натрия с хлоридом кальция:[5]
- .
Примечания
- , легко растворяющиеся в воде и спирте и имеющие плотность 2,711 г/см3кальция хлорат дигидрат, «Справочник химика» т.2, Л.-М.: Химия, 1964 стр. 96-97
- Хлорат-хлорид кальция // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Десиканты // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Позин, 1974, Получение хлората калия известковым методом, с. 1464—1469.
- Позин, 1974, Хлораты кальция и магния, с. 1470.
Литература
- Позин М. Е. Гл. XXXIX. Соли кислородных кислот хлора. → Хлораты натрия, калия, кальция и магния // Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот). — издание 4. — Л.: «Химия», 1974. — Т. 2. — С. 1430—1479. — 768 (792-1556) с.
