Тяжёлые цепи иммуноглобулинов
Тяжёлые цепи иммуноглобулинов (immunoglobulin heavy chain) — это большие полипептидные субъединицы иммуноглобулинов (антител).
Молекулы антител состоят из двух тяжёлых и двух лёгких цепей. Различные варианты тяжёлых цепей соответствуют изотипам иммуноглобулинов. Типы тяжёлых цепей отличаются у разных видов животных. Все тяжёлые цепи содержат иммуноглобулиновые домены — обычно один вариабельный домен, который обуславливает связывание антигена и несколько константных доменов.
У млекопитающих
Классы
У млекопитающих классифицируют пять типов тяжёлых цепей γ, δ, α, μ и ε.[1] Типы тяжёлых цепей соответствуют классам иммуноглобулинов.
- Тяжёлые цепи α и γ состоят примерно из 450 остатков аминокислот.
- Тяжёлые цепи μ и ε состоят примерно из 550 остатков аминокислот[1].
Участки
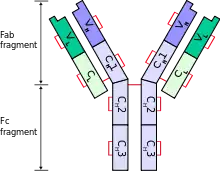
Каждая тяжелая цепь имеет два участка:
- константный участок, одинаковый у всех иммуноглобулинов одного класса, но отличающийся между классами
- вариабельный участок, который отличается между разными В-лимфоцитами, но одинаковый среди всех иммуноглобулинов, синтезированных одним В-лимфоцитом или одним клоном. Вариабельные домены всех тяжёлых цепей состоят из одного иммуноглобулинового домена. Такие домены имеют длину около 110 остатков аминокислот.
У рыб
Челюстные рыбы являются наиболее примитивными животными, способными образовывать антитела, подобные тем, что образуют млекопитающие.[3] Однако, рыбы не имеют такого репертуара антител, какой характерен для млекопитающих.[4] Три различных вида тяжёлых цепей обнаружены и у костных рыб.
- Первыми описанными тяжёлыми цепями были μ (или мю). Тяжёлые цепи такого типа представлены у всех челюстных рыб и считаются базовыми для всех иммуноглобулинов. Образующиеся антитела IgM, секретируются у челюстных рыб в виде тетрамера (в отличие от акул и млекопитающих, у которых IgM представляют собой пентамеры).
- Тяжёлые цепи δ, представленные в IgD были впервые обнаружены у сомов и атлантического лосося, и в настоящее время описаны и для других костистых рыб.[5]
- Третий тип тяжёлых цепей костистых рыб описан относительно недавно, и не соответствует какому-либо типу тяжёлых цепей млекопитающих. Такие тяжёлые цепи описаны для радужной форели (τ)[6] и Данио рерио (ζ).[7]
Три различных типа тяжёлых цепей иммуноглобулинов описаны и у хрящевых рыб.[8]
Примечания
- Janeway C. A., Jr. et al. Immunobiology (неопр.). — 5th ed.. — Garland Publishing, 2001.
- Woof J., Burton D. Human antibody-Fc receptor interactions illuminated by crystal structures (англ.) // Nat Rev Immunol : journal. — Nature Publishing Group, 2004. — Vol. 4, no. 2. — P. 89—99. — doi:10.1038/nri1266. — PMID 15040582.
- Fish heavy chain and light chain genes Архивировано 23 марта 2007 года.
- Eva Bengtén, L. William Clem, Norman W. Miller, Gregory W. Warr and Melanie Wilson. Channel catfish immunoglobulins: Repertoire and expression. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 77-92.
- Stein Tore Solem and Jørgen Stenvik. Antibody repertoire development in teleosts--a review with emphasis on salmonids and Gadus morhua L. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 57-76.
- J.D. Hansen, E.D. Landis and R.B. Phillips. Discovery of a unique Ig heavy-chain isotype (IgT) in rainbow trout: Implications for a distinctive B cell developmental pathway in teleost fish. Proceedings of the National Academy of Sciences U S A. Volume 102, Issue 19, 2005, pages 6919-24.
- N. Danilova, J. Bussmann, K. Jekosch, L.A Steiner. The immunoglobulin heavy-chain locus in zebrafish: identification and expression of a previously unknown isotype, immunoglobulin Z. Nature Immunology, Volume 6, Issue 3, 2005, pages 295—302.
- H. Dooley and M.F. Flajnik. Antibody repertoire development in cartilaginous fish. Developmental & Comparative Immunology, Volume 30, Issues 1-2, Antibody repertoire development, 2006, Pages 43-56.