Рецепторные тирозинкиназы
Рецепторные тирозинкиназы, рецепторы с тирозинкиназной активностью (англ. Receptor Tyrosin Kinases, сокр. RTK) — метаботропные клеточные рецепторы, представляют собой трансмембранные белки, которые состоят из каталитического внутриклеточного домена, участвующего в фосфорилировании субстратов (тирозинкиназа), трансмембранного и внешнего домена (связывающего) с высоким сродством к лигандам: гормонам (инсулин), цитокинам и полипептидным факторам роста[1][2]. Из 90 уникальных генов тирозинкиназы, идентифицированных в геноме человека, 58 кодируют рецепторные тирозинкиназы[3].
| receptor protein-tyrosine kinase | |
|---|---|
 | |
| Идентификаторы | |
| Шифр КФ | 2.7.10.1 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| Рецепторные тирозинкиназы | |
|---|---|
 | |
| Идентификаторы | |
| Символ | Pkinase_Tyr |
| Pfam | PF07714 |
| OPM superfamily | 186 |
| OPM protein | 2k1k |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Было показано, что рецепторные тирозинкиназы не только являются ключевыми регуляторами нормальных клеточных процессов, но также играют критическую роль в развитии и прогрессировании многих типов злокачественных опухолей[4]. Мутации в рецепторных тирозинкиназах приводят к активации ряда сигнальных каскадов, которые оказывают многочисленные воздействия на экспрессию белка. Рецепторные тирозинкиназы являются частью более широкого семейства протеинтирозинкиназ, охватывающих рецепторные тирозинкиназные белки, которые содержат трансмембранный домен, а также нерецепторные тирозинкиназы, которые не обладают трансмембранными доменами[5].
История
Первыми RTK, которые обнаружили, были EGF (сокр. от англ. epidermal growth factor) и NGF (сокр. от англ. nerve growth factor) в 1960-х годах, однако классификация рецепторных тирозинкиназ не была разработана до 1970-х годов[6].
Структура
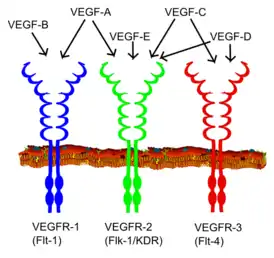
Большинство RTK являются рецепторами, состоящих из одной субъединицы, но некоторые существуют в виде мультимерных комплексов, например, инсулиновый рецептор, который образует дисульфид-связанные димеры в присутствии молекул гормона (инсулина); кроме того, связывание лиганда с внеклеточным доменом вызывает образование димеров рецептора[7]. Каждый мономер имеет один гидрофобный трансмембранно-охватывающий домен, состоящий из 25-38 аминокислотных остатков, внеклеточную N-концевую область и внутриклеточную С-концевую область[8]. Внеклеточная N-концевая область обладает множеством консервативных элементов, включая иммуноглобулин (Ig)-подобный или эпидермальный фактор роста (EGF)-подобные домены, повторы фибронектина типа III или богатые цистеином области, которые характерны для каждого подсемейства RTK; эти домены содержат в основном лиганд-связывающий сайт, который ответственен за связывание внеклеточных лигандов, например, факторов роста или гормонов. Внутриклеточная С-концевая область обладает наивысшим уровнем консервативности и содержит каталитические домены, ответственные за киназную активность этих рецепторов, которая катализирует аутофосфорилирование рецепторов и фосфорилирование остатков тирозина, являющихся субстратами RTK.
Передача сигнала
С помощью различных средств внеклеточное связывание лиганда обычно вызывает или стабилизирует димеризацию рецептора. Это позволяет трансфосфорилировать тирозин в цитоплазматической части каждого мономера рецептора его партнёрским рецептором, распространяя сигнал через плазматическую мембрану. Фосфорилирование специфических остатков тирозина в активированном рецепторе создает сайты связывания для белков, src-гомологичные домены 2 (SH2) и связывающий домен фосфотирозина (PTB). Специфические белки, содержащие данные домены, включают Src и фосфолипазу Cγ. Фосфорилирование и активация этих двух белков при связывании рецептора приводят к инициации путей передачи сигнала. Другие белки, которые взаимодействуют с активированным рецептором, как адаптерные белки не имеют собственной ферментативной активности. Эти адаптерные белки связывают процесс активации молекул RTK с нисходящими сигнальными путями трансдукции, такими как сигнальный каскад MAP-киназы. Примером жизненно важного пути трансдукции сигнала является рецепторная тирозинкиназа, c-met, которая необходима для выживания и пролиферации мигрирующих миобластов во время миогенеза (роста и развития мышечной ткани). Недостаток c-met нарушает вторичный миогенез и как в LBX1-препятствует формированию мускулатуры конечностей. Такое локальное действие FGF (факторов роста фибробластов) с их рецепторами RTK классифицируется как паракринная передача сигналов. Поскольку молекулы RTK фосфорилируют множество остатков тирозина, они могут активировать множество путей передачи сигнала.
Регуляция
Путь рецептора тирозинкиназы (RTK) тщательно регулируется различными положительными и отрицательными петлями обратной связи[9]. поскольку RTKs координируют широкий спектр клеточных функций, таких как пролиферация и дифференцировка клеток, они должны регулироваться для предотвращения серьёзных нарушений в функционировании клеток, таких как рак и фиброз[10].
Примечания
- Hanks SK, Quinn AM, Hunter T. The protein kinase family: conserved features and deduced phylogeny of the catalytic domains (англ.) // Science. — 1988. — Vol. 241, no. 4861. — P. 42—52.
- Dengjel J, Kratchmarova I, Blagoev B. Receptor tyrosine kinase signaling: a view from quantitative proteomics (англ.) // Mol Biosyst. — 2009. — Vol. 5, no. 10. — P. 1112—1121.
- Robinson D. R., Wu Y. M., Lin S. F. The protein tyrosine kinase family of the human genome (англ.) // Oncogene : journal. — 2000. — November (vol. 19, no. 49). — P. 5548—5557. — doi:10.1038/sj.onc.1203957. — PMID 11114734.
- Zwick E., Bange J., Ullrich A. Receptor tyrosine kinase signalling as a target for cancer intervention strategies (англ.) // Endocrine-Related Cancer : journal. — 2001. — September (vol. 8, no. 3). — P. 161—173. — doi:10.1677/erc.0.0080161. — PMID 11566607.
- Hubbard S. R., Till J. H. Protein tyrosine kinase structure and function (англ.) // Annual Review of Biochemistry : journal. — 2000. — Vol. 69. — P. 373—398. — doi:10.1146/annurev.biochem.69.1.373. — PMID 10966463.
- Schlessinger, J. Receptor Tyrosine Kinases: Legacy of the First Two Decades (англ.) // Cold Spring Harbor Perspectives in Biology : journal. — 2014. — 3 March (vol. 6, no. 3). — P. a008912. — doi:10.1101/cshperspect.a008912. — PMID 24591517.
- Lodish et al. Molecular cell biology (неопр.). — 5th. — 2003.
- Hubbard S. R. Structural analysis of receptor tyrosine kinases (неопр.) // Progress in Biophysics and Molecular Biology. — 1999. — Т. 71, № 3—4. — С. 343—358. — doi:10.1016/S0079-6107(98)00047-9. — PMID 10354703.
- Ostman A., Böhmer F. D. Regulation of receptor tyrosine kinase signaling by protein tyrosine phosphatases (англ.) // Trends in Cell Biology : journal. — Cell Press, 2001. — June (vol. 11, no. 6). — P. 258—266. — doi:10.1016/s0962-8924(01)01990-0. — PMID 11356362.
- Haj F. G., Markova B., Klaman L. D., Bohmer F. D., Neel B. G. Regulation of receptor tyrosine kinase signaling by protein tyrosine phosphatase-1B (англ.) // The Journal of Biological Chemistry : journal. — 2003. — January (vol. 278, no. 2). — P. 739—744. — doi:10.1074/jbc.M210194200. — PMID 12424235.