Пренилирование
Пренилирование (или изопренилирование, или липидирование) — биохимический процесс присоединения гидрофобных молекул к белку или другому химическому веществу. Обычно считается, что пренильные группы (3-метилбут-2-ен-1-ил) облегчают присоединение молекул к клеточным мембранам, также как, «липидные якорные белки» (англ.), такие как, например, гликозилфосфатидилинозитол, хотя прямое доказательство этого пока не найдено. Доказано, что пренильные группы являются важным элементом для протеин-протеиновой связи посредством специальных пренил-связывающих доменов.
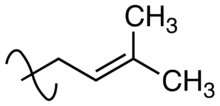
Пренилирование белков
Пренилирование белков включает в себя передачу либо фарнезила, либо геранил-геранильного остатка к С-терминалу цистеина белка-мишени. Существуют три фермента, которые осуществляют пренилирование в клетке: фарнезил-трансфераза, Caax-протеаза и геранил-геранил трансфераза I.[1].
Фарнезилтрансфераза и геранилгеранилтрансфераза I
Фарнезилтрансфераза и геранилгеранилтрансфераза I — очень похожие белки. Они состоят из двух субъединиц, субъединицы-α, которая одинакова у двух ферментов, и из субъединицы β, которая идентична у двух белков только на 25 %. Эти ферменты распознают отдел CaaX на конце-C белка-мишени. C это принелированный цистеин, a это любая алифатическая аминокислота, а значение X определяет, какой фермент действует на белок. Фарнезилтрансфераза узнает отделы CaaX, где X = M, S, Q, A, или C, в то время как геранилгеранилтрансфераза I распознает отделы CaaX, где X = L или E.
Ингибиторы
Ингибиторы фарнезилтрансферазы (англ.) могут быть использованы для ингибирования фарнезилирования в организмах паразитов, таких как trypansoma brucii (вызывает сонную болезнь, переносчик муха Цеце) и малярия. Паразиты являются более чувствительными к ингибиторам фарнезилтрансферазы, чем люди. В некоторых случаях это может происходить из-за того, что у них нет геранилгеранилтрансферазы I. Таким образом, возможна разработка антипаразитарных средств «заодно» с развитием ингибиторов фарнезилтрансферазы для лечения рака.
Кроме того, ингибиторы фарнезилтрансферазы оказались успешными в лечении прогерии, и в мае 2007 года началась II фаза клинических испытаний препарата «Lonafarnib» для детей, больных прогерией.[2]
В преобразовании сигнала посредством белка G, пальмитирование субъединицы α, пренилирование субъединицы γ и миристиолирование вовлечены в связывании белка G ко внутренней поверхности плазметической мембраны таким образом, что белок G может взаимодействовать с его рецептором.[3].
Пренилирование малых молекул
Малые молекулы также могут быть пренилированы, как, например, пренилированные флавоноиды (англ.). Недавно была описана прениляция производного витамина B2 (мононуклеотида флавина).[4]
Важным классом веществ, широко исследуемым сегодня являются пренилированные производные флороглюцинола, как, например, гиперфорин.
Примечания
- P. J. Casey, M. C. Seabra. Protein Prenyltransferases (англ.) // Journal of Biological Chemistry : journal. — 1996. — Vol. 271, no. 10. — P. 5289—5292. — doi:10.1074/jbc.271.10.5289. — PMID 8621375. PDF
- Phase II trial of Lonafarnib (a farnesyltransferase inhibitor) for progeria (англ.) : journal.
- The structure of the G protein heterotrimer Gi alpha 1 beta 1 gamma 2. (англ.) // Cell : journal. — Cell Press, 1995. — 15 December (vol. 83, no. 6). — P. 1047—1058. — doi:10.1016/0092-8674(95)90220-1. — PMID 8521505.
- Biochemistry: Unexpected role for vitamin B2 (англ.) // Nature. — Vol. 522. — P. 427—428. — doi:10.1038/nature14536.