Нейрофибриллярный клубок
Нейрофибриллярные клубки — скопления белка, обнаруживаемые в мозге при болезни Альцгеймера[1], впервые описанные Алоисом Альцгеймером при посмертном анализе тканей мозга одного из пациентов. Показано, что клубки образуются гиперфосфорилированным тау-белком и располагаются в нейронах мозга. Неясно, являются ли эти скопления одним из основных патологических факторов или играют менее заметную роль в патогенезе. Нейрофибриллярные клубки обнаруживаются и при других патологиях, называемых таупатиями.
Формирование
Нейрофибриллярные клубки образуются гиперфосфорилированием тау-белка, относящегося к группе белков, ассоциированных с микротрубочками. Фосфорилирование приводит к агрегации белка, переводу его в нерастворимую форму. Точный механизм формирования клубка не известен.
Изменения цитоскелета
При использовании метода иммуноокрашивания было выделено три стадии формирования нейрофибриллярного клубка. На стадии 0 морфологически нормальные пирамидальные нейроны окрашиваются диффузно антителами к тау-белку. Другими словами, клетки здоровы и присутствие тау-белка минимально. На стадии 1 появляются тонкие длинные включения, окрашиваемые антителами к тау-белку (это ранние клубки). Стадия 2 характеризуется классическими нейрофибриллярными клубками. На стадии 3 нейрон уже мёртв и клубки располагаются за пределами клетки. На этой стадии окрашивание к тау-белку уменьшается, но усиливается окрашивание к убиквитину[2].
Причины
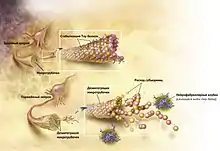
Мутация тау-белка
Традиционно считается, что тау-белок связывается с микротрубочками и принимает участие в их формировании и стабилизации. Однако, при гиперфосфорилировании белок не может выполнять свою функцию, микротрубочки становятся нестабильными и начинают распадаться. Несвязанный тау-белок формирует скопления, которые и называют нейрофибриллярными клубками[3]. Это связано с чрезмерным (гипер-) фосфорилированием тау-белка, часто приходящемся на неверные аминокислотные остатки.
Черепно-мозговая травма
Черепно-мозговая травма может являться одним из факторов образования нейрофибриллярных клубков[4]. Гиперфосфорилирование часто встречается в центральной нервной системе после повторных черепно-мозговых травм[5]. Точный механизм связывающий черепно-мозговые травмы с гиперфосфорилированием тау-белка остаётся неясным[4].
Патология
Было показано, что степень когнитивных нарушений при таких заболеваниях, как болезнь Альцгеймера достоверно коррелирует с наличием нейрофибриллярных клубков[10]. Однако, некоторыми авторами высказывалось предположение, что формирование нейрофибриллярных клубков не имеет каузальных (причинно-следственных) связей с развитием заболеваний. Напротив, нейрофибриллярные клубки могут являться компенсаторной реакцией в ответ на окислительный стресс и выполнять защитную функцию. Такое утверждение основано на нескольких фактах. Во-первых, некоторые нейроны, содержащие нейрофибриллярные клубки, могут выживать в течение десятков лет[3]. Во-вторых, нейрофибриллярные клубки были обнаружены у здоровых людей, следовательно нейрофибриллярные клубки не связаны напрямую с дегенерацией нейронов.
Лечение
Было показано, что статины уменьшают количество нейрофибриллярных клубков при моделировании таупатии у мышей[11]. Циклин-зависимая киназа 5 (CDK5) — киназа, которая предположительно участвует в формировании таупатии. РНК-интерференция может являться одной из стратегий лечения таупатий, поскольку уменьшает экспрессию CDK5 гена. Нокдаун гена CDK5 уменьшал фосфорилирование тау-белка в культуре клеток и в моделях на мышах. Кроме того, снижение экспрессии этого гена уменьшало количество нейрофибриллярных клубков[12].
Препараты лития
Препараты лития уменьшают фосфорилирование тау-белка и плотность нейрофибриллярных клубков в гиппокампе и спинном мозге в моделях на мышах[13]. Однако, восстановления рабочей памяти и моторных функций у мышей после курса препаратов лития не происходило.
Примечания
- Струков А. И., Серов В. В. Болезни центральной нервной системы // Патологическая анатомия: учебник. — 5-е изд. — М.: Литтерра, 2010. — С. 591. — 848 с.
- Bancher, C. Accumulation of abnormally phosphorylated τ precedes the formation of neurofibrillary tangles in Alzheimer's disease : [англ.] / C. Bancher, C. Brunner, H. Lassmann … [et al.] // Brain research : журн.. — 1989. — Vol. 477, no. 1—2 (January). — P. 90—99. — ISSN 0006-8993. — doi:10.1016/0006-8993(89)91396-6. — PMID 2495152.
- Lee H. et al. Tau phosphorylation in Alzheimer's disease: pathogen or protector? (англ.) // Trends in Molecular Medicine. — 2005-01-04. — Vol. 11, no. 4. — P. 164-169. — ISSN 1471-4914. — doi:10.1016/j.molmed.2005.02.008.
- Lucke-Wold B. P. et al. Linking Traumatic Brain Injury to Chronic Traumatic Encephalopathy: Identification of Potential Mechanisms Leading to Neurofibrillary Tangle Development (англ.) // Journal of Neurotrauma. — 2014-07-01. — Vol. 31, no. 13. — P. 1129-1138. — ISSN 0897-7151. — doi:10.1089/neu.2013.3303.
- Mannix R. et al. Clinical correlates in an experimental model of repetitive mild brain injury (англ.) // Annals of Neurology. — 2013-07-01. — Vol. 74, no. 1. — P. 65-75. — ISSN 1531-8249. — doi:10.1002/ana.23858.
- Olivieri G. et al. Mercury induces cell cytotoxicity and oxidative stress and increases beta-amyloid secretion and tau phosphorylation in SHSY5Y neuroblastoma cells (англ.) // Journal of Neurochemistry. — 2000-01-01. — Vol. 74, no. 1. — P. 231-236. — ISSN 0022-3042.
- Vahidnia A. et al. Arsenic-induced neurotoxicity in relation to toxicokinetics: effects on sciatic nerve proteins (англ.) // Chemico-Biological Interactions. — 2008-11-25. — Vol. 176, no. 2-3. — P. 188-195. — ISSN 1872-7786. — doi:10.1016/j.cbi.2008.07.001.
- Bihaqi S. W., Zawia N. H. Enhanced taupathy and AD-like pathology in aged primate brains decades after infantile exposure to lead (Pb) (англ.) // Neurotoxicology. — 2013-12-01. — Vol. 39. — P. 95-101. — ISSN 1872-9711. — doi:10.1016/j.neuro.2013.07.010.
- Shin R. W. et al. A novel trivalent cation chelator Feralex dissociates binding of aluminum and iron associated with hyperphosphorylated tau of Alzheimer's disease (англ.) // Brain Research. — 2003-01-24. — Vol. 961, no. 1. — P. 139-146. — ISSN 0006-8993.
- Braskie M. N. et al. Plaque and tangle imaging and cognition in normal aging and Alzheimer's disease (англ.) // Neurobiology of Aging. — Vol. 31, no. 10. — P. 1669-1678. — doi:10.1016/j.neurobiolaging.2008.09.012.
- Boimel M. et al. Statins reduce the neurofibrillary tangle burden in a mouse model of tauopathy (англ.) // Journal of Neuropathology and Experimental Neurology. — 2009-03-01. — Vol. 68, no. 3. — P. 314-325. — ISSN 0022-3069. — doi:10.1097/NEN.0b013e31819ac3cb.
- Piedrahita D. et al. Silencing of CDK5 Reduces Neurofibrillary Tangles in Transgenic Alzheimer's Mice (англ.) // The Journal of neuroscience : the official journal of the Society for Neuroscience. — 2010-10-20. — Vol. 30, no. 42. — P. 13966-13976. — ISSN 0270-6474. — doi:10.1523/JNEUROSCI.3637-10.2010.
- Leroy K. et al. Lithium treatment arrests the development of neurofibrillary tangles in mutant tau transgenic mice with advanced neurofibrillary pathology (англ.) // Journal of Alzheimer's disease : журнал. — 2010. — Vol. 19, no. 2. — P. 705-719. — doi:10.3233/jad-2010-1276.