Каликсарены
Каликсарены — это макроциклические соединения, продукты циклической олигомеризации фенола с формальдегидом [1]. Название каликсарен (calixarene) впервые было предложено Давидом Гютше (David Gutsche) [2] и происходит от латинского слова «calix» или «chalice» чаша, что отображает особенную форму молекулы (рис.1) и слова «арен (arene)» указывающее на ароматический строительный блок данного соединения.
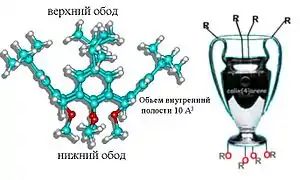
В составе классических каликсаренов можно выделить верхний, центральный кольцевой обод и нижний обод, образованные трет-бутильными заместителями в пара-положении, ароматическими ареновыми фрагментами и гидрокси- или алкокси-заместителями в нижнем положении макроцикла соответственно. В совокупности данные структурные фрагменты формируют внутреннюю полость молекулы каликсарена, объём которой в среднем равен 10 кубическим ангстремам.
Номенклатура
В связи с неудобством номенклатуры ИЮПАК для названия каликсаренов, так же как и других объектов супрамолекулярной химии применяется тривиальная номенклатура, учитывающая особенности строения макро(гетеро)цикла — номенклатура Д. Гютше, в основе которой лежит название простейшего представителя каликсаренов, показанного на рисунке 2.
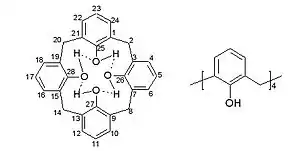
В соответствии с номенклатурой Гютше данное соединение называется 25,26,27,28-тетрагидроксикаликс[4]ареном, где число в квадратных скобках указывает на размер макроцикла, а природа и положение заместителей в ароматическом ядре уточняется соответствующими цифрами и дескрипторами. На данный момент название данной структуры является основой номенклатуры для обширного класса модифицированных каликсаренов, резорцинаренов, тиакаликсаренов с различным числом ареновых фрагментов.
История
Начало развития химии каликсаренов связано с именем немецкого ученого Адольфа Фон Байера (Adolf von Baeyer, 1835 −1917). Проведенная им реакция бензальдегида с пирогаллолом в присутствии сильной кислоты, привела к образованию полимера [3], структура которого так и осталась не установленной в связи с недостаточным развитием аналитических методов в то время. Байером предполагалось использовать данные соединения как красители в текстильной промышленности. Следующий шаг в развитии химии каликсаренов был сделан бельгийцем Лео Бакеландом, исследовавшим реакцию конденсации формальдегида с фенолом, которая также привела к образованию полимера [4]. Первая попытка контроля реакции полимеризации была проделана Цинге и Циглером (Alois Zinke и Erich Ziegler). Использованный ими пара-трет-бутилфенол, в котором заместитель в пара- положении ингибирует образование разветвленных полимеров, в результате реакции с формальдегидом в льняном масле в присутствии NaOH образует линейный полимер [5]. В тот же год Ниедерл и Фогель (Niederl, Vogel) проведя реакцию практически в тех же условиях но, используя вместо фенола замещенный резорцин, смогли добиться образования циклического тетрамера, будущего каликс[4]резорцинарена [6], что являлось настоящим прорывом в развитии химии каликсаренов. Д. Корнфорт (John Cornforth) в 1955 году был одним из первых кто осознал потенциал каликсаренов как чаше-подобных соединений, аналогов ферментов и повторив эксперименты Цинге и Циглера, доказал что данная смесь содержит несколько компонентов.
Синтез
Впервые получить эти соединения методом ступенчатой циклизации удалось в 1956 году группе Хантера [7]. Методом постадийной конденсации 2-бром-4-алкилзамещенных фенолов в бисфенольное производное были получены линейные олигомеры с тремя и четырьмя фенольными фрагментами. После дебромирования на последней стадии в результате внутримолекулярной циклизации было получено производное, имевшее в своём составе четыре ароматических фрагмента. Подобная методика синтеза макроцикла в дальнейшем была использована так же Каммерером с сотр. для получения других каликсаренов [8].
| Реагенты | Основание | Растворитель | Температура | Продукт | |
|---|---|---|---|---|---|
| CH2O | NaOH | Дифенилоксид | 259 °C | n=4 | |
| KOH RbOH | Ксилол | 139 °C | n=6 | ||
| NaOH | Ксилол | 139 °C | n=8 | ||
| S8 | NaOH | MeOH(CH2CH2O)4Me | 230 °C | тио n=4 [9] | |
Существенным недостатком методов ступенчатой циклизации являлся низкий (5-30 %, в зависимости от размера макроцикла) выход конечных продуктов. Повышение эффективности реакций циклизации стало возможным благодаря работам группы Д. Гютше, в которых синтез трет-бутилкаликс[4,6,8]аренов проводился с использованием темплатного эффекта и привёл к образованию макроциклов с высокими (50-82 %) выходами [2]. Из таблицы следует, что результат реакции циклизации зависит от размера катиона щелочного металла, гидроксид которого используется как основа, и температуры протекания реакции. Таким образом было установлено, что трет-бутилкаликс[8]арен это продукт кинетического контроля, трет-бутилкаликс[4]арен — термодинамического, а трет.-бутилкаликс[6]арен — темплатного контроля, то есть получается исключительно в случае использования КОН или RbOH. Темплатный эффект предполагает четкое соответствие между размерами катиона щелочного металла и размерами образующегося макроцикла. Последующие изучение комплексов (алкокси)каликсаренов с ионами щелочных и щелочноземельных металлов позволило выявить ряд условий для образования прочных комплексов такого состава, к которым относятся соответствие размеров иона металла и полости макроцикла, пространственное расположение атомов кислорода в нижнем ободе макроцикла, и заряд иона металла. В данный момент известен подход к синтезу разнообразного числа каликсарен производных соединений с различными мостиковыми группами (С, S, Se) и различным количеством от 3 до 20 [10] структурных блоков (ареновых фрагментов). Но, несмотря на столь огромное разнообразие каликсарен производных соединений включая каликсрезорцинарены, наибольшее применение как органические рецепторы получили каликсареновые и тиокаликсареновые платформы с 4,6, и в редких случаях с 8 ареновыми фрагментами.
Стереохимия
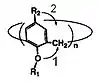
Каликсарены могут существовать во множестве различных конформаций за счет возможности двух типов инверсии [11] кислород-через-центральный-обод (oxygen-through-annulus) и пара-заместитель-через-центральный-обод (para-substituent-through-annulus) (рис. 3). Следует отметить, что трансанулярное вращение становится невозможным только за счет введения объемных групп, как в нижний обод макроцикла, так и в пара — положениях ароматических колец (верхний обод).
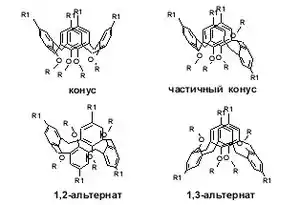
Производные каликс[4]аренов и тиокаликс[4]аренов могут находиться в четырех основных конформациях [12] (рис.1) конус (а), частичный конус (b), 1,2-альтернат (c), и 1,3-альтернат (d) (рис.4), которые отличаются взаимным положением ароматических фрагментов относительно главной плоскости макроцикла, которая условно проходит по метиленовым связкам. Следует выделять конформационно мобильные и конформационно жесткие остовы каликсаренов, то есть каликсарены в которых возможны или не возможны переходы между основными конформациям.
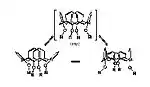
Расчеты по методам молекулярной механики вместе с методом ЯМР (1H, 13C) показали, что для конформации конус в растворе наблюдается быстрый динамический переход уплощенный конус-уплощенный конус (рис.5),[13] за счет перехода двух вертикально ориентированных ароматических фрагментов в наклонное положения, а двух других — из наклонного положения в вертикальное. Поэтому в растворе все четыре ареновых фрагмента эквивалентны, данный факт наблюдается так же для каликсаренов с большим количеством структурных фрагментов [14].
Применение
Благодаря описанным в данной статье преимуществам, каликсарены находят широкое применение в различных отраслях промышленности. Так в аналитической химии на основе каликсареновых платформ синтезированы рецепторы для селективного и/или группового извлечения ионов различных металлов: щелочных металлов (Na(I), K(I), Cs(I), Li(I)), щелочноземельных металлов (Ca(II), Mg(II)) [15] и переходных металлов (Ag(I), Pd(II), Au(III), Hg(II)) [16].Применение технологии молекулярного распознавания позволяет разработать катализаторы на основе макроциклических каликсареновых платформ, для которых активность и селективность определяется межмолекулярными взаимодействиями субстрат- катализатор [17]. При этом возможно рассмотрение каталитических систем, включающих некоординированные макроциклические рецепторы выступающие, в качестве «микрореакторов» стабилизирующих переходное состояние реакции или влияющего на регио- и стереоселективность процесса за счет специфической ориентации субстрата. Особое внимание исследователей привлекают катализаторы представленные металлическим центром и лигандом, Таким образом, связывания субстрата полостью лиганда-рецептора определяет его ориентацию по отношению к металлическому центру, что существенно влияет на распределение продуктов и субстратную селективность реакции. В гомогенном катализе возможно использование комплексов на основе серосодержащих каликсаренов с золотом для каталитического окисления различных вредных сульфидов, например горчичного газа, в мягких условиях [18] . В биохимии каликсарены находят использование как соединения-аналоги ферментов, с помощью которых возможно моделирование сложных ферментативных процессов. Так тетраметокси(тио)каликсарен может выступать в качестве аналога белка аквапорина, для моделирования транспорта воды через клеточную мембрану [19] . В твердой фазе каликсарены находятся в качестве бислоистых структур с ориентацией молекул "голова к голове", образуя внутреннюю полость, способную включать молекулы гостей строго определенного размера [20] . Этвудом было установлено, что данные кристаллические соединения могут абсорбировать диоксид углерода и практически не абсорбируют водород, что может быть использовано для очищения последнего при риформинге для дальнейшего использования водорода в топливном элементе [21].
Примечания
- Gutsche, C. David (1989). Calixarenes. Cambridge: Royal Society of Chemistry.
- Gutsche C.D., In Calixarenes Revisited, Monographs in supramolecular chemistry; Stoddart J.F., Ed.;The Royal Society of Chemistry: Cambridge, U.K.,1998.
- A. Baeyer, Ber., (1872), 5, 25, 280, 1094.
- L.H. Baekeland, U.S. Patent 942,699
- Zinke A., Ziegler E., Ber. (1941), B74, P.1729.
- J. B. Niederl and H. J. Vogel, (1940) J. Am. Chem. Soc., 62, 2512.
- Hayes B.T., Hunter R.F.,(1958), J. Appl. Chem. 1958. V. 8. P. 743—748.
- Kammerer H., Happel G., Caesar F., (1972), Makromol. Chem. 1972. V. 162. P. 179.
- Iki. N., Miyano S. Can Thiacalixarene Surpass Calixarene? // Journal of Inclusion Phenomena and Macrocyclic Chemistry, 41 (2001), 1-4 (декабрь), 99-105.
- D.R.Stewart, C.D.Gutsche, Isolation, Characterization, and Conformational Characteristics of p-tert-Butylcalix[9-20]arenes//J. Am. Chem. Soc. (1999), 121, 4136-4146.>
- Ikeda A., Shinkai S., Novel Cavity Design Using Calix[n]arene Skeletons: Toward Molecular Recognition and Metal Binding, Chem. Rev. 1997, 97, 1713—1734.
- Gutsche C.D., Dhawan B., Levine J.A., No K.H., Bauer L.J. Conformational Isomers of The Ethers and Esters of Calix[4]arenes// Tetrahedron.- 1983.- V. 39.- № 3.- P. 409—426.
- Conner M., Janout V., Regen S.L. Pinched-Cone Conformers of Calix[4]arenes // J.Am.Chem.Soc.- 1991.- V. 113.- P. 9670-9671.
- van Hoorn, W. P.; van Veggel, F. C. J. M.; Reinhoudt, D. N, Conformation of Hexahydroxycalix[6]arene, J. Org. Chem., 1996, 61(20), 7180-7184.
- R. Ludwig, Calixarenes in analytical and separation chemistry, Fresenius J Anal Chem (2000) V.367, P.103-128.
- Torgov V., Kostin G., Mashukov V., Korda T., Drapaillo A., Kalchenko V. //J. Solvent Extraction and Ion Exchange, 23, 171—187, 2005.
Torgov V., Kostin G., Korda T., Stoyanov E., Kalchenko V., Drapaillo A., Kasyan O., Wipff G., Varnek A. //J. Solvent Extraction and Ion Exchange, 23, 781—801, 2005. - Э. А. Караханов, А. Л. Максимов, Е. А. Рунова, Создание супрамолекулярных металлокомплексных каталитических систем для органического и нефтехимического синтеза // Успехи химии, 74 (2005), 1 (январь), 104—119.
- E. Boring, Y.V. Geletii, C.L. Hill, Catalytic aerobic oxidation of 2-chloroethyl ethylsulfide, a mustard simulant, under ambient conditions — Effect of solvents, ligands, and transition metals on reactivity// Journal of Molecular Catalysis A: Chemical, 176 (2001), 1-2 (ноябрь 20), 49-63.
- Thallapally PK, Lloyd GO, Atwood JL, Barbour LJ (2005). «Diffusion of water in a nonporous hydrophobic crystal». Angewandte Chemie (International ed. in English) 44 (25): 3848-51.
- Polymorphism of pure p-tert-butylcalix[4]arene: conclusive identification of the phase obtained by desolvation // CHEM. COMMUN., 2002, 2952—2953
- Jerry L. Atwood,* Leonard J. Barbour,* Praveen K. Thallapally and Trevor B. Wirsig A crystalline organic substrate absorbs methane under STP conditions Chem. Commun., 2005, 51-53