Диэтилцинк
Диэтилцинк — металлоорганическое соединение цинка с формулой Zn(С2H5)2. При комнатной температуре представляет собой устойчивую, но реакционноспособную бесцветную жидкость.
| Диэтилцинк | |
|---|---|
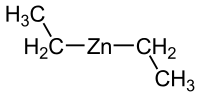 | |
| Общие | |
| Систематическое наименование |
Диэтилцинк |
| Хим. формула | Zn(С2H5)2 |
| Рац. формула | ZnС4H10 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 123,43 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | -30 °C |
| • кипения | 118 °C |
| • разложения | >200 °C |
| Классификация | |
| Рег. номер CAS | 557-20-0 |
| PubChem | 101667988 |
| Рег. номер EINECS | 209-161-3 |
| SMILES | |
| InChI | |
| ChEBI | 51496 |
| ChemSpider | 10413128 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- Взаимодействие металлического цинка с диэтилртутью:
- Реакция хлорида цинка и иодида этилмагния:
- Разложение иодида этилцинка:
Физические свойства
Диэтилцинк образует устойчивую бесцветную жидкость, плавится при −30 °С, кипит при 118 °С, разлагается при нагревании выше 200 °С.
Химические свойства
- Окисляется на воздухе, обычно с воспламенением:
- Соединение хорошо реагирует с водой, аммиаком, спиртами и другими кислородсодержащими органическими веществами:
- Окисляется эфирным раствором пероксида водорода с образованием пероксида цинка ZnO2.
Безопасность
Диэтилцинк является пирофорным веществом, то есть самопроизвольно загорается при контакте с воздухом. По этой причине эксперименты с этим веществом необходимо проводить в инертной атмосфере (азот, аргон, диоксид углерода). Температура самовозгорания диэтилцинка равна −18 °С[1], что позволяет отнести его к категории особо опасных ЛВЖ.
См. также
Примечания
- PubChem. Diethylzinc (англ.). pubchem.ncbi.nlm.nih.gov. Дата обращения: 16 января 2020.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
