Вольфрамат натрия
Вольфрамат натрия — неорганическое соединение, натриевая соль вольфрамовой кислоты. Бесцветные ромбические кристаллы, растворимые в воде. Образует дигидрат.
| Вольфрамат натрия | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Вольфрамат натрия |
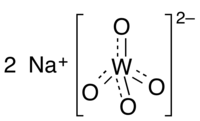
| Хим. формула | Na2WO4 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 293,83 г/моль |
| Плотность | 4,18 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 696 °C |
| Энтальпия | |
| • образования | -1548 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде |
57,5 (0 °C) 73 (20 °C) 96,8 (100 °C) г/100 мл |
| Классификация | |
| Рег. номер CAS | 13472-45-2 |
| PubChem | 26052 |
| Рег. номер EINECS | 236-743-4 |
| SMILES | |
| InChI | |
| RTECS | YO7875000 |
| ChEBI | 63940 |
| ChemSpider | 24266 |
| Безопасность | |
| ЛД50 | 240 мг/кг |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
Вольфрамат натрия получают следующими способами:
- Растворением оксида вольфрама(VI) в растворе или расплаве гидроксида натрия.
- Сплавлением гидроксида или карбоната натрия с оксидом вольфрама (VI):
- Окислением вольфрама расплавом нитрата и гидроксида натрия:
Химические свойства
- Проявляет окислительные свойства:
- Вступает в обменные реакции:
- Разлагается сильными кислотами:
Применение
Промежуточный продукт при переработке вольфрамовых концентратов. Применяют при производстве пигментов.
Токсичность
Токсичен, смертельная доза для крыс орально (ЛД50) — 250 мг/кг.
Литература
- «Химический энциклопедический словарь». — под ред. Кнунянц И. Л. — М.: Советская энциклопедия, 1983, — с.361
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник». — Л.: Химия, 1977, — с. 84
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
