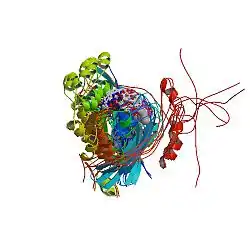
Белок синдрома Вискотта — Олдрича
Белок синдрома Вискотта — Олдрича (англ. The Wiskott–Aldrich Syndrome Protein, WASp) состоит из 502 остатков аминокислот[1] и имеет сложное доменное строение. Он экспрессируется в гемопоэтических клетках, играет важную роль в реорганизации цитоскелета, сигнальной трансдукции и апоптозе[2].
Ген WAS, мутации в котором приводят к развитию синдрома Вискотта — Олдрича, локализован на коротком плече Х-хромосомы в области Хp11.4 — Хp11.21. Точнее, ген WAS расположен от 48,683,789 до 48,691,426-й пары оснований на Х-хромосоме[3]. Картирование гена было произведено в 1994 году, было установлено, что ген WAS состоит из 12 экзонов и 11 интронов[4] общей протяженностью приблизительно 1800 пар нуклеотидов[5][6].
На С-конце белка WASp, в непосредственной близости один от другого, расположены домены связывания мономерного актина и Агр2/3-комплекса. Это обеспечивает пространственное сближение этих молекул и облегчает процесс полимеризации актина. На N-конце и в центральной части белка находятся различные регуляторные домены (WH1, GBD, Роlу-Рrо-участок), обеспечивающие взаимосвязь со множеством специальных белковых молекул и фосфолипидов мембран. Таким образом, белок WASp может служить посредником при взаимодействии различных специфических факторов с мембранными структурами и участвовать в процессе полимеризации актина[7][8].
Возникновение мутации в гене, ответственном за синтез белка WASp, приводит к появлению дефектной формы белка или к полному его отсутствию, что влечёт за собой развитие нарушений иммунитета и гемостаза. Известно не менее 350 мутаций[3] в гене WAS, ответственных за развитие Х-сцепленного синдрома Вискотта — Олдрича. Основное их количество приходится на нуклеотидные замены (миссенс-/нонсенс-мутации), мутации сплайсинга и малые делеции. Выявляются так же малые инсерции и большие делеции[9].
У больных с миссенс-мутациями, как правило, наблюдается лёгкое течение заболевания, проявляющееся преимущественно тромбоцитопенией. Для пациентов с различными делециями, вставками нуклеотидов, нонсенс-мутациями и мутациями сайтов сплайсинга характерны более тяжёлые клинические проявления[10][11].
Примечания
- P42768[1-502], Wiskott-Aldrich syndrome protein, Homo sapiens
- Синдром Вискотта-Олдрича. Резюме (pdf). orpha.net (2013). Дата обращения: 7 января 2017.
- A service of the U.S. National Library of Medicine: Genetics Home Reference
- WAS — Wiskott-Aldrich syndrome (eczema-thrombocytopenia) Архивировано 1 февраля 2014 года., Resource of Asian Primary Immunodeficiency Diseases (RAPID)
- Derry J. M., Ochs H. D., Francke U. Isolation of a novel gene mutated in Wiskott-Aldrich syndrome. (англ.) // Cell. — 1994. — Vol. 78, no. 4. — P. 635—644. — PMID 8069912.
- chrX:48542185-48549817 7,633 bp. UCSC Genome Browser on Human Feb. 2009 (GRCh37/hg19) Assembly
- Гусев Н. Б. Движение немышечных клеток и реорганизация актиновых микрофиламентов // Соросовский образовательный журнал. — 2001. — Т. 7, № 7. — С. 9—16.
- Thrasher A. J., Burns S. Wiskott-Aldrich syndrome: a disorder of haematopoietic cytoskeletal regulation. (англ.) // Microscopy research and technique. — 1999. — Vol. 47, no. 2. — P. 107—113. — doi:10.1002/(SICI)1097-0029(19991015)47:2<107::AID-JEMT3>3.0.CO;2-H. — PMID 10523789.
- База данных: HGMD — Human Gene Mutation Database.
- Lemahieu V., Gastier J. M., Francke U. Novel mutations in the Wiskott-Aldrich syndrome protein gene and their effects on transcriptional, translational, and clinical phenotypes. (англ.) // Human mutation. — 1999. — Vol. 14, no. 1. — P. 54—66. — doi:10.1002/(SICI)1098-1004(1999)14:1<54::AID-HUMU7>3.0.CO;2-E. — PMID 10447259.
- Lutskiy M. I., Rosen F. S., Remold-O'Donnell E. Genotype-proteotype linkage in the Wiskott-Aldrich syndrome. (англ.) // Journal of immunology (Baltimore, Md. : 1950). — 2005. — Vol. 175, no. 2. — P. 1329—1336. — PMID 16002738.
Ссылки
Сермягина И. Г., Забненкова В. В., Кондратенко И. В., Поляков А. В., ДНК-диагностика синдрома Вискотта-Олдрича // Медицинская генетика, 2009 г., т. 8, N6(84), с. 34—39 (недоступная ссылка)