2A-пептиды
2A-пепти́ды (англ. 2A self-cleaving peptides, 2A peptides) — группа пептидов длиной от 18 до 22 аминокислотных остатков (а. о.), которые способны к самовырезанию из полипептидной цепи, благодаря чему используются в генетической инженерии для получения рекомбинантных белков в эквимолярных пропорциях. 2A-пептиды синтезируются с участка 2A вирусного генома[1][2]. Названия 2A-пептидам даны по тем вирусов, из которых они были получены. Так, F2A был получен из вируса ящура Foot-and-mouth disease virus[1].
Виды
В генетической инженерии активно используются 2A-пептиды четырёх видов: P2A, E2A, F2A и T2A. F2A получен из вируса foot-and-mouth disease virus 18; E2A получен из вируса лошадиного ритинита A (англ. equine rhinitis A virus); P2A получен от вируса porcine teschovirus-1 2A, а T2A получен от вируса thosea asigna 2A[1].
К последовательности пептида на N-конце можно добавить последовательность GSG (глицин-серин-глицин)[3].
| Название | Последовательность |
|---|---|
| T2A | (GSG) EGRGSLL TCGDVEENPGP |
| P2A | (GSG) ATNFSLLKQAGDVEENPGP |
| E2A | (GSG) QCTNYALLKLAGDVESNPGP |
| F2A | (GSG) VKQTLNFDLLKLAGDVESNPGP |
Описание
Каким образом 2А разделяет полипептидные цепи в точности неизвестно. Оно происходит во время трансляции между остатками пролина (P) и глицина (G) на C-конце 2A-пептида[4][5]. Существует предположение, что при синтезе 2A-пептидов происходит не настоящее протеолитическое расщепление, а «проскок» рибосомы, в результате которого пептидная связь между остатками глицина и пролина просто не формируется[6][7].
Разные 2A-пептиды имеют разную эффективность образования двух полипетидов. P2A делает это наиболее эффективно, а F2A — наименее эффективно[8]. По этой причине при использовании F2A-пептида до половины разделённых им белков остаются в виде гибридного белка[9].
Функции 2A-пептидов у вирусов их производящих плохо изучены. В 2018 году было показано, что F2A необходим для правильного процессинга белков и репликации вируса Foot-and-Mouth Disease Virus[10].
Применение
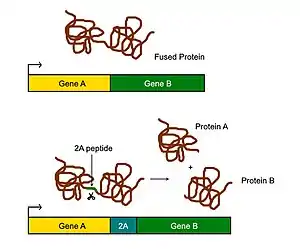
2A-пептиды применяются в генетической инженерии для расщепления длинного полипептида на два пептида. Их применяют в тех случаях, когда получить белок, сшитый из двух разных полипептидов, не удаётся. После действия 2A-пептида два новых пептида укладываются и функционируют независимо[3]. Если к конструкту, помимо разделяющего два гена 2A-пептида, добавить IRES, то становится возможным получить три разных белка с одного транскрипта[1]. С использованием 2A-пептидов получают полицистронные векторы, кодирующие несколько белков[1].
2A-пептиды были успешно применены для решения многих задач, например, получения моноклональных антител[11][12]. Разработаны специализированные версии 2A-пептидов для эффективного синтеза нужных белков у тутового шелкопряда[13]. 2A-пептиды используются и при работе с дрожжами[14]. Их также использовали для повышения экспрессии гетерологичных генов у съедобного гриба опёнка зимнего, поэтому 2A-пептиды могут использоваться в генетической инженерии грибов[15].
Примечания
- Liu Z., Chen O., Wall JBJ, Zheng M., Zhou Y., Wang L., Ruth Vaseghi H., Qian L., Liu J. Systematic comparison of 2A peptides for cloning multi-genes in a polycistronic vector. (англ.) // Scientific Reports. — 2017. — 19 May (vol. 7, no. 1). — P. 2193—2193. — doi:10.1038/s41598-017-02460-2. — PMID 28526819.
- Sampath Karuna; Roy Sudipto. Live Imaging In Zebrafish: Insights Into Development And Disease (англ.). — World Scientific, 2010. — P. 51—52. — ISBN 978-981-4464-89-5.
- Szymczak-Workman A. L., Vignali K. M., Vignali D. A. Design and construction of 2A peptide-linked multicistronic vectors. (англ.) // Cold Spring Harbor Protocols. — 2012. — 1 February (vol. 2012, no. 2). — P. 199—204. — doi:10.1101/pdb.ip067876. — PMID 22301656.
- Wang Y., Wang F., Wang R., Zhao P., Xia Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. (англ.) // Scientific Reports. — 2015. — 5 November (vol. 5). — P. 16273—16273. — doi:10.1038/srep16273. — PMID 26537835.
- Cleavage Activity of Aphtho- and Cardiovirus 2A Oligopeptidic Sequences. (недоступная ссылка). University of St Andrews. Дата обращения: 4 августа 2019. Архивировано 30 декабря 2016 года.
- Doronina V. A., de Felipe P., Wu C., Sharma P., Sachs M. S., Ryan M. D., Brown J. D. Dissection of a co-translational nascent chain separation event. (англ.) // Biochemical Society Transactions. — 2008. — August (vol. 36, no. Pt 4). — P. 712—716. — doi:10.1042/BST0360712. — PMID 18631146.
- Donnelly M. L., Luke G., Mehrotra A., Li X., Hughes L. E., Gani D., Ryan M. D. Analysis of the aphthovirus 2A/2B polyprotein 'cleavage' mechanism indicates not a proteolytic reaction, but a novel translational effect: a putative ribosomal 'skip'. (англ.) // The Journal Of General Virology. — 2001. — May (vol. 82, no. Pt 5). — P. 1013—1025. — doi:10.1099/0022-1317-82-5-1013. — PMID 11297676.
- Kim J. H., Lee S. R., Li L. H., Park H. J., Park J. H., Lee K. Y., Kim M. K., Shin B. A., Choi S. Y. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. (англ.) // Public Library of Science ONE. — 2011. — Vol. 6, no. 4. — P. e18556. — doi:10.1371/journal.pone.0018556. — PMID 21602908.
- Velychko S., Kang K., Kim S. M., Kwak T. H., Kim K. P., Park C., Hong K., Chung C., Hyun J. K., MacCarthy C. M., Wu G., Schöler H. R., Han D. W. Fusion of Reprogramming Factors Alters the Trajectory of Somatic Lineage Conversion. (англ.) // Cell Reports. — 2019. — 2 April (vol. 27, no. 1). — P. 30—39. — doi:10.1016/j.celrep.2019.03.023. — PMID 30943410.
- Kjær J., Belsham G. J. Modifications to the Foot-and-Mouth Disease Virus 2A Peptide: Influence on Polyprotein Processing and Virus Replication. (англ.) // Journal Of Virology. — 2018. — 15 April (vol. 92, no. 8). — doi:10.1128/JVI.02218-17. — PMID 29386286.
- Chng J., Wang T., Nian R., Lau A., Hoi K. M., Ho S. C., Gagnon P., Bi X., Yang Y. Cleavage efficient 2A peptides for high level monoclonal antibody expression in CHO cells. (англ.) // MAbs. — 2015. — Vol. 7, no. 2. — P. 403—412. — doi:10.1080/19420862.2015.1008351. — PMID 25621616.
- Lin J., Neo S. H., Ho SCL, Yeo JHM, Wang T., Zhang W., Bi X., Chao S. H., Yang Y. Impact of Signal Peptides on Furin-2A Mediated Monoclonal Antibody Secretion in CHO Cells. (англ.) // Biotechnology Journal. — 2017. — September (vol. 12, no. 9). — doi:10.1002/biot.201700268. — PMID 28727292.
- Wang Y., Wang F., Xu S., Wang R., Chen W., Hou K., Tian C., Wang F., Zhao P., Xia Q. Optimization of a 2A self-cleaving peptide-based multigene expression system for efficient expression of upstream and downstream genes in silkworm. (англ.) // Molecular Genetics And Genomics : MGG. — 2019. — August (vol. 294, no. 4). — P. 849—859. — doi:10.1007/s00438-019-01534-2. — PMID 30895377.
- Souza-Moreira T. M., Navarrete C., Chen X., Zanelli C. F., Valentini S. R., Furlan M., Nielsen J., Krivoruchko A. Screening of 2A peptides for polycistronic gene expression in yeast. (англ.) // FEMS Yeast Research. — 2018. — 1 August (vol. 18, no. 5). — doi:10.1093/femsyr/foy036. — PMID 29617770.
- Lin Y. J., Huang L. H., Huang C. T. Enhancement of heterologous gene expression in Flammulina velutipes using polycistronic vectors containing a viral 2A cleavage sequence. (англ.) // PloS One. — 2013. — Vol. 8, no. 3. — P. e59099—59099. — doi:10.1371/journal.pone.0059099. — PMID 23516605.