Тозил
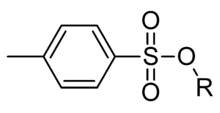
Тозил (сокращенно Ts или Tos) имеет молекулярную формулу п-CH3C6H4SO2. Эта группа обычно вводится с помощью тозилхлорида (TsCl). Обычно сульфогруппа имеет пара-ориентацию (см. рисунок), и под тозилом понимают п-толуолсульфанильную группу.
Тозилат — анион п-толуолсульфоновой кислоты (п-CH3C6H4SO3−), обозначается как TsO−. Под тозилатами также понимают сложные эфиры п-толуолсульфоновой кислоты.
Применение
Тозилаты очень гладко вступают в реакцию SN2, без образования побочных продуктов. В алкилтозилаты могут быть легко переведены спирты в реакции с тозилхлоридом. В ходе реакции, свободная электронная пара кислорода молекулы спирта атакует атом серы тозилхлорида, замещает собой хлор и образует тозилат с сохранением оптической конфигурации исходного спирта. Этот факт обуславливает высокую важность тозильной группы, так как гидроксильная группа в реакции SN2 уходит с трудом, в отличие от тозильной.
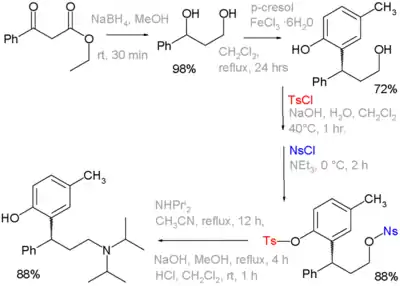
Тозильная группа также используется в качестве протекторной в органическом синтезе. Например, гидроксильная группа переводится в тозилатную, а на финальных стадиях синтеза ее гидролизуют обратно в гидроксильную. Такое применение она нашла в синтезе препарата толтеродин, в котором на одной из стадий фенольная группа защищается тозильной, а спиртовая — нозильной. Затем тозильная группа отщепляется действием щелочи, а нозильная замещается диизопропиламином[1][2]:
Также тозил применяется для защиты аминогруппы. Получающийся сульфонамид обладает высокой стабильностью. Аминогруппа может быть депротектирована с помощью восстановителей или сильных кислот.[3]
Родственные вещества
На тозилаты очень похожи нозилаты и брозилаты, представляющие собой соответственно п-нитробензосульфонаты и п-бромбензосульфонаты.
См. также
Примечания
- Kathlia A. De Castro, Jungnam Ko, Daejong Park, Sungdae Park, and Hakjune Rhee. Reduction of Ethyl Benzoylacetate and Selective Protection of 2-(3-Hydroxy-1-phenylpropyl)-4-methylphenol: A New and Facile Synthesis of Tolterodine (англ.) // Organic Process Research & Development : journal. — 2007. — Vol. 11, no. 5. — P. 918. — doi:10.1021/op7001134.
- Reaction sequence: organic reduction of ethyl benzoylacetate by sodium borohydride to a diol, followed by Friedel-Crafts alkylation with p-cresol and iron(III) chloride to a phenol.
- Greene, T. W.; Wuts, P. G. M. Protective Groups In Organic Synthesis (неопр.). — New York: John Wiley & Sons, 1999. — С. 603—607. — ISBN 9780471160199.