Сигма-связь
Си́гма-связь (σ-связь) — ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии», соединяющей ядра атомов. Характеризуется осевой симметрией.

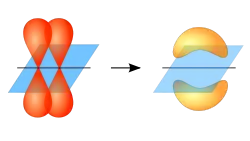
Концепцию Сигма- и Пи- связей сформулировал дважды лауреат Нобелевской премии Лайнус Полинг в 30-х годах прошлого века[1]. Идея включала гибридизацию атомных орбиталей, рассчитанную с помощью простых алгебраических действий.
Считалось, что сигма-связь образуется за счёт перекрывания вытянутых гибридных орбиталей (рис. 1), а пи-связь образуется за счёт перекрывания p-орбиталей (рис. 2).
Однако сам Л. Полинг не был удовлетворён описанием сигма- и пи-связей. На симпозиуме по теоретической органической химии, посвящённом памяти А. Кекуле (Лондон, сентябрь 1958 года), он раскритиковал и отказался от σ, π — описаний и предложил теорию изогнутой химической связи[2]. Последняя теория чётко учитывала физический смысл ковалентной химической связи.
Основная характеристика сигма-связи (длина и прочность) зависит от электронной конфигурации атомов, образующих сигма-связь. Характеристика сигма-связи[3]:
| Молекула | Электронная конфигурация атома | Орбитальный радиус атома, Å | Длина связи, Å | Энергия разрыва связи, кДж/моль |
|---|---|---|---|---|
| H2 | ------ 1S1 | 0,53 | 0,74 | 436 |
| Li2 | [He] 2S1 | 1,57 | 2,67 | 102 |
| Na2 | [Ne] 3S1 | 1,715 | 3,08 | 73 |
| K2 | [Ar] 4S1 | 2,09 | 3,92 | 57 |
| Rb2 | [Kr] 5S1 | 2,22 | 4,10 | 49 |
| Cs2 | [Xe] 6S1 | 2,35 | 4,30 | 42 |
Чем больше электронное экранирование ядра атома, тем удалённее от ядра единственный валентный электрон электронной оболочки атома, тем больше длина сигма-связи и меньше её прочность.
Примечания
- Паулинг Л. Природа химической связи / под. ред. Я.К.Сыркина. — М.—Л.: Издательство химической литературы, 1947. — 440 с.
- Полинг Л. Кекуле и химическая связь (книга "Теоретическая органическая химия") / под. ред. Р.Х.Фрейдлиной. — М.—Л.: Издательство иностранной литературы, 1963. — С. 7-16. — 366 с.
- Лидин Р.А, Андреева Л.Л, Молочко В.А. Справочник по неорганической химии. Константы неорганических веществ. — М.: Химия, 1987. — С. 132-136. — 320 с.