Овальбумин
Овальбумин или альбумин яичный (ovalbuminum) — альбумин яичного белка. Основной белок яичного белка (около 60-65%)[2]. Масса овальбумина, выделенного из куриных яиц, составляет 45 кДа[3]. На основании структурной гомологии овальбумин относится к группе белков-серпинов, однако он не обладает способностью ингибировать сериновые протеазы[4]. Овальбумин был одним из первых белков, выделенных в чистом виде в 1889 году. Функция его до конца не выяснена; он считается резервом белков для развития зародыша[5].
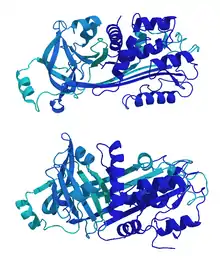
Структура
Овальбумин, выделенный из куриного яйца, имеет массу около 45кДа и состоит из 385 аминокислотных остатков. Молекулярная масса его полипептидной цепи составляет 42699 Да. Пептидная цепь овальбумина подвергается посттрансляционной модификации: его N-конец ацетилируется, аспартат в 292 позиции гликозилируется, 68 и 344 сериновые остатки фосфорилируются[3]. Существует три фракции овальбумина в зависимости от количества фосфорилированных остатков: два у овальбумина А1, один у овальбумина А2 и ни одного у овальбумина А3[6].
Синтез и секреция овальбумина осуществляется клетками яйцевода курицы под влиянием эстрогенов[7]. Продукт трансляции транскрипта гена овальбумина, как и в случае с другими секреторными белками, имеет сигнальную последовательность, обеспечивающую его транспорт к эндоплазматической сети. Однако, в отличие от большинства других секретирующихся белков, сигнальная последовательность овальбумина расположена не с N-конца, а внутри полипептидной цепи (с 21 по 47 аминокислотный остаток) и не отщепляется[8].
Применение
- Применяется в кондитерской промышленности[9];
- Используется в фотографии, в процессе альбуминовой печати;
- Овальбумин является важным белком для различных областей исследований, в том числе:
- общего исследования структуры и свойств белка (потому что она доступна в большом количестве);
- исследования структуры и функции серпина;
- Протеомика (овальбумин куриного яйца обычно используется как маркер молекулярного веса для калибровки геля для электрофореза);
- Иммунология (обычно используется для стимулирования аллергических реакций у испытуемых).
См. также
Примечания
- "Crystal structure of uncleaved ovalbumin at 1.95 A resolution." Stein, P.E., Leslie, A.G., Finch, J.T., Carrell, R.W. Journal: (1991) J.Mol.Biol. 221: 941-959
- “Structure and properties of ovalbumin.” Huntington JA, Stein PE. J Chromatogr B Biomed Sci Appl. 2001 May 25;756(1-2):189-98.
- “The complete amino-acid sequence of hen ovalbumin.” Nisbet AD, Saundry RH, Moir AJ, Fothergill LA, Fothergill JE. Eur J Biochem. 1981 Apr;115(2):335-45.
- “Alpha-to-beta structural transformation of ovalbumin: heat and pH effects.” Hu HY, Du HN.J Protein Chem. 2000 Apr;19(3):177-83.
- "Ovalbumin in Developing Chicken Eggs Migrates from Egg White to Embryonic Organs while Changing Its Conformation and Thermal Stability." Yasushi Sugimoto et al.April 16, 1999 The Journal of Biological Chemistry, 274, 11030-11037.
- "Albumen protein and functional properties of gelation and foaming."Ana Cláudia Carraro Alleoni. Sci. agric. (Piracicaba, Braz.) vol.63 no.3 Piracicaba May/June 2006
- “Hormonal Regulation of Ovalbumin Synthesis in Chick Oviduct” R. T. Schimke, R. Palacios, R. D. Palmiter, R. E. Rhoads. Gene Expression and its Regulation Basic Life Sciences 1973, pp 123-135
- “Isolation and properties of the signal region from ovalbumin.” Robinson A, Meredith C, Austen BM. FEBS Lett. 1986 Jul 28;203(2):243-6.
- Кнунянц, 1983.
Литература
- Альбумин яичный : статья // Химический энциклопедический словарь / Гл. ред. Кнунянц И. Л. — М. : Сов. энциклопедия, 1983. — С. 27. — 792 с.
Ссылки
- ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА, ХИМИЧЕСКИЙ СОСТАВ ЯИЦ
- Овальбумин — Технический словарь Том II
- Ovalbumin