Миостатин
Миостати́н (также известный как фактор роста и дифференцировки 8) — белок, который подавляет рост и дифференцировку мышечной ткани. Образуется в мышцах животных, затем выделяется в кровь, оказывая своё действие на мышцы за счёт связывания с рецепторами ACVR2B (activin type II receptor). У человека миостатин закодирован в гене MSTN.
| Миостатин | ||||||
|---|---|---|---|---|---|---|
| Идентификаторы | ||||||
| Символы | growth/differentiation factor 8MSTN | |||||
| Внешние IDs | GeneCards: | |||||
| Ортологи | ||||||
| Виды | Человек | Мышь | ||||
| Entrez |
|
| ||||
| Ensembl |
|
| ||||
| UniProt |
|
| ||||
| RefSeq (мРНК) |
|
| ||||
| RefSeq (белок) |
|
| ||||
| Локус (UCSC) | n/a | n/a | ||||
| Поиск PubMed | n/a | |||||
| Править (человек) | ||||||
Исследования на животных показывают, что блокирование действия миостатина приводит к значительному увеличению сухой мышечной массы с практически полным отсутствием жировой ткани.
Открытие
Ген, кодирующий миостатин, был обнаружен в 1997 генетиками Александрой Макпэрроной и Си-Джин Лином. Получив чистую линию мышей с неработающим геном миостатина, они доказали, что отсутствие гена миостатина вызывает значительное повышение мышечной массы. Аналогичные генетические аномалии встречаются у некоторых мясных пород коров, а также известны у малой английской борзой и человека.
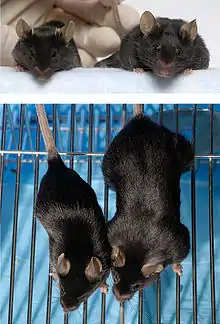

Мутации
Миостатин активен в мышцах, используемых для движения (скелетные мышцы) до и после рождения. Это обычно ограничивает рост мышц, гарантируя, что мышцы не становятся слишком большими. Мутации, которые уменьшают производство миостатина, приводят к чрезмерно быстрому росту мышечной ткани. Люди с мутацией в обеих копиях гена MSTN (гомозиготы) имеют значительно увеличенную мышечную массу и силу. У людей с мутацией в одной копии гена MSTN (гетерозигот) также увеличена мышечная масса, но в меньшей степени.
В 2004 в Германии был обнаружен мальчик с мутацией в обеих копиях гена[1]. Он был значительно сильнее своих сверстников. У его матери есть мутация в одной копии гена. У американского мальчика, родившегося в 2005, Лиэма Хоекстра[2], клиническая картина сходная, но её причина иная: его тело производит нормальный уровень миостатина, но, поскольку его мускулатура более развитая, чем у его ровесников, его доктор полагает, что дефект в его миостатиновых рецепторах препятствует тому, чтобы его мышечные клетки нормально реагировали на миостатин.
Биохимия
Человеческий миостатин состоит из двух идентичных субъединиц, каждая из которых состоит из 109 аминокислотных остатков. Его полная молекулярная масса составляет 25 кДа. Белок синтезируется в неактивной форме. Для того, чтобы активировать белок, протеаза расщепляет NH2-концевую часть.
Клиническое исследование
Дальнейшее исследование миостатина может привести к открытию новых методов лечения мышечной дистрофии. Тем не менее, остается неясным, выгодно ли долгосрочное лечение мышечной дистрофии с использованием ингибиторов миостатина, поскольку истощение стволовых клеток мышц может ухудшить течение болезни на более поздних стадиях.[3]
На бройлерных цыплятах было доказано, что при приёме креатина уровень миостатина понижается.[4]
Примечания
- Myostatin Mutation Associated with Gross Muscle Hypertrophy in a Child / N Engl J Med 2004;350:2682-8 PMID 15215484 (англ.)
- Associated Press (2007-05-30). "CTV.ca | Rare condition gives toddler super strength". CTVglobemedia.
- Дюшенна (–Гризингера) (прогрессирующая) мышечная дистрофия | Саратовский неврологический портал
- Chen, J.; Wang, M.; Kong, Y.; Ma, H.; Zou, S. Comparison of the novel compounds creatine and pyruvateon lipid and protein metabolism in broiler chickens (англ.) // Animal : journal. — 2011. — Vol. 5, no. 7. — P. 1082—1089. — doi:10.1017/S1751731111000085. — PMID 22440103.
Ссылки
- Myostatin-Related Muscle Hypertrophy / GeneReviews, 2013 (англ.)
- Double muscling in cattle due to mutations in the myostatin gene // Proc. Natl. Acad. Sci. USA, Vol. 94, pp. 12457–12461, November 1997 (англ.)
- Mutations in myostatin (GDF8) in Double-Muscled Belgian Blue and Piedmontese Cattle / Genome Res. 1997. 7: 910-915, doi:10.1101/gr.7.9.910 (англ.)