Конканавалин A
Конканавалин A (КонА, ConA) — белок растительного происхождения, лектин, получаемый из растения семейства бобовые канавалии мечевидной. Входит в группу легуминов. КонА специфически связывается с опеределёнными структурами сахаров, гликопротеинов и гликолипидов, как правило, содержащих внутренние и восстановелнные концевые остатки α-D-маннозы и α-D-глюкозы[2][3].
| Конканавалин A | |
|---|---|
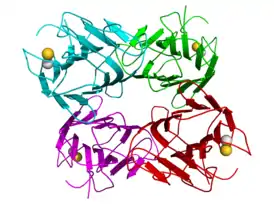 Кристаллическая структура тетрамера конканавалина A (отдельные мономеры показаны синим, зелёным, красным и фиолетовым цветами). Ионы кальция и марганца показаны как сферы жёлтого и белого цвета, соотв.[1] | |
| Обозначения | |
| Символы | КонА; ConA |
| CAS | 11028-71-0 |
| UniProt | P81461 |
КонА является растительным митогеном, который известен своей способностью стимулировать мышиные T-лимфоциты с образованием 4 функционально отличных популяций T-клеток, включая предшественники Т-супрессоров[4], а также подгруппу человеческих Т-супрессоры[4]. Исторически КонА был первым лектином, который удалось выделять на коммерческой основе, поэтому белок широко используется в биологии и биохимии для характеристики гликопротеинов и других сахаро-содержащих клеточных компонентов[5]. Он также применяется для очистки гликозилированных макромолекул в аффинной хроматографии[6] и при изучении иммунной регуляции различных иммунных клеток[4].
Структура и свойства
Как и большинство лектинов КонА — гомотетрамер, каждая субъединица которого имеет молекулярную массу 26,5 кДа, состоит из 235 аминокислот с высоким уровнем гликозилирования и связана с ионами металлов, как правило, Mn2+ и Ca2+. Молекула имеет деэдральную D2 симметрию[1]. Третичная структура белка была разрешена,[7] включая взаимодействия с ионами металлов и аффинность к сахарам маннозы и глюкозы[8].
КонА специфически связывается с остатками α-D-маннозы и α-D-глюкозы (две гексозы, которые отличаются только по гидроксильной группе в положении C-2) в концевом положении в бета-гликанах. Тетрамер КонА имеет 4 связывающих участка[3]; молекулярная масса 104-112 кДа; изоэлектрическая точка pI 4.5-5.5.
КонА инициирует клеточное деление (митогенез), в основном T-лимфоцитов, за счёт стимуляции энергетического метаболизма клетки в течение секунд после экспонирования[9].
Биологическая активность
Конканавалин A взаимодействует с многочисленными рецепторами, содержащими остатки маннозы, включая родопсин, некоторые маркеры групп крови, инсулиновые рецептор[10], иммуноглобулины и раково-эмбриональный антиген (CEA), а также липопротеины[11].
КонА агглютинирует эритроциты, не зависимо от группы крови, а также раковые клетки[12][13][14]. Было обнаружено, что КонА не агглютинирует трансформированные клетки или нормальные клетки, обработанные трипсином, при температуре 4 °C, что предполагает температуро-зависимый этап реакции агглютинации[15][16].
Было показано, что КонА способен агглютинировать мышечные клетки[17], B-лимфоциты (за счёт поверхностных иммуноглобулинов]]),[18] фибробласты,[19] тимоциты крысы,[20] фетальные эпителиальные клетки кишечника человека (но не взрослого человека),[21] и адипоциты[22].
КонА является лимфоцитарным митогеном. Подобно фитогемагглиютинину (ФГА, PHA), специфически стимулирующему T-лимфоциты, КонА стимулирует B-клетки. КонА связывает и перешивает компоненты Т-клеточного рецептора, поэтому его стимулирующая способность зависит от уровня экспрессии Т-клеточного рецептора на поверхности клетки[23][24].
КонА взаимодействует с поверхностными остатками маннозы на клеточной поверхности таких бактерий как E. coli,[25] Bacillus subtilis[26] или простейшего Dictyostelium discoideum[27].
КонА может активировать несколько матриксных металлопротеиназ (MMPs)[28].
КонА широко используется для твёрдофазной иммобилизации гликоэнзимов, особенно в случаях, когда иммобилизация за счёт привязки через ковалентные связи не подходит. КонА-покрытый матрикс позволяет иммобилизовать такие ферменты в больших количествах без потере их каталитической активности. Кроме этого, связывание фермента с помощью КонА является обратимым процессом и фермент может быть высвобожден с матрикса за счёт инкубирования с сахарами или понижением pH. Это взаимодействие также при необходимости может использоваться для последующей ковалентной пришивки[29].
См. также
Примечания
- PDB 3CNA; Hardman K. D., Ainsworth C. F. Structure of concanavalin A at 2.4-A resolution (неопр.) // Biochemistry. — 1972. — December (т. 11, № 26). — С. 4910—4919. — doi:10.1021/bi00776a006. — PMID 4638345.
- Goldstein, Irwin J.; Poretz, Ronald D. Isolation, physicochemical characterization, and carbohydrate-binding specificity of lectins // The Lectins Properties, Functions and Applications in Biology and Medicine (англ.) / Liener, Irvin E.; Sharon, Nathan; Goldstein, Irwin J.. — Elsevier, 2012. — P. 33—247. — ISBN 978-0-323-14444-5.
- Sumner J. B., Gralën N., Eriksson-Quensel I. B. The Molecular Weights of Urease, Canavalin, Concanavalin a and Concanavalin B (англ.) // Science : journal. — 1938. — April (vol. 87, no. 2261). — P. 395—396. — doi:10.1126/science.87.2261.395. — . — PMID 17746464.
- Dwyer J. M., Johnson C. The use of concanavalin A to study the immunoregulation of human T cells (англ.) // Clinical and Experimental Immunology : journal. — 1981. — November (vol. 46, no. 2). — P. 237—249. — PMID 6461456.
- Schiefer H. G., Krauss H., Brunner H., Gerhardt U. Ultrastructural visualization of surface carbohydrate structures on mycoplasma membranes by concanavalin A (англ.) // American Society for Microbiology : journal. — 1975. — December (vol. 124, no. 3). — P. 1598—1600. — PMID 1104592.
- GE Healthcare Life Sciences, Immobilized lectin Архивировано 3 марта 2012 года.[необходимо уточнить]
- Min W., Dunn A. J., Jones D. H. Non-glycosylated recombinant pro-concanavalin A is active without polypeptide cleavage (англ.) // The EMBO Journal : journal. — 1992. — April (vol. 11, no. 4). — P. 1303—1307. — doi:10.1002/j.1460-2075.1992.tb05174.x. — PMID 1563347.
- Loris R., Hamelryck T., Bouckaert J., Wyns L. Legume lectin structure (англ.) // Biochimica et Biophysica Acta : journal. — 1998. — March (vol. 1383, no. 1). — P. 9—36. — doi:10.1016/S0167-4838(97)00182-9. — PMID 9546043.
- Krauss S., Buttgereit F., Brand M. D. Effects of the mitogen concanavalin A on pathways of thymocyte energy metabolism (англ.) // Biochimica et Biophysica Acta : journal. — 1999. — June (vol. 1412, no. 2). — P. 129—138. — doi:10.1016/S0005-2728(99)00058-4. — PMID 10393256.
- Cuatrecasas P., Tell G. P. Insulin-like activity of concanavalin A and wheat germ agglutinin--direct interactions with insulin receptors (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1973. — February (vol. 70, no. 2). — P. 485—489. — doi:10.1073/pnas.70.2.485. — . — PMID 4510292. — .
- Harmony J. A., Cordes E. H. Interaction of human plasma low density lipoprotein with concanavalin A and with ricin (англ.) // The Journal of Biological Chemistry : journal. — 1975. — November (vol. 250, no. 22). — P. 8614—8617. — PMID 171260.
- Betton G. R. Agglutination reactions of spontaneous canine tumour cells, induced by concanavalin A, demonstrated by an isotopic assay (англ.) // International Journal of Cancer : journal. — 1976. — November (vol. 18, no. 5). — P. 687—696. — doi:10.1002/ijc.2910180518. — PMID 992901.
- Kakizoe T., Komatsu H., Niijima T., Kawachi T., Sugimura T. Increased agglutinability of bladder cells by concanavalin A after administration of carcinogens (англ.) // Cancer Research : journal. — American Association for Cancer Research, 1980. — June (vol. 40, no. 6). — P. 2006—2009. — PMID 7371036.
- Becker F. F., Shurgin A. Concanavalin A agglutination of cells from primary hepatocellular carcinomas and hepatic nodules induced by N-2-fluorenylacetamide (англ.) // Cancer Research : journal. — American Association for Cancer Research, 1975. — October (vol. 35, no. 10). — P. 2879—2883. — PMID 168971.
- Inbar M., Ben-Bassat H., Sachs L. A specific metabolic activity on the surface membrane in malignant cell-transformation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1971. — November (vol. 68, no. 11). — P. 2748—2751. — doi:10.1073/pnas.68.11.2748. — . — PMID 4330939. — .
- Sela B. A., Lis H., Sharon N., Sachs L. Quantitation of N-acetyl-D-galactosamine-like sites on the surface membrane of normal and transformed mammalian cells (англ.) // Biochimica et Biophysica Acta : journal. — 1971. — December (vol. 249, no. 2). — P. 564—568. — doi:10.1016/0005-2736(71)90132-5. — PMID 4332414.
- Gartner T. K., Podleski T. R. Evidence that a membrane bound lectin mediates fusion of L6 myoblasts (англ.) // Biochemical and Biophysical Research Communications : journal. — 1975. — December (vol. 67, no. 3). — P. 972—978. — doi:10.1016/0006-291X(75)90770-6. — PMID 1201086.
- de Petris S. Concanavalin A receptors, immunoglobulins, and theta antigen of the lymphocyte surface. Interactions with concanavalin A and with Cytoplasmic structures (англ.) // The Journal of Cell Biology : journal. — 1975. — April (vol. 65, no. 1). — P. 123—146. — doi:10.1083/jcb.65.1.123. — PMID 1092699.
- Noonan K. D., Burger M. M. The relationship of concanavalin A binding to lectin-initiated cell agglutination (англ.) // The Journal of Cell Biology : journal. — 1973. — October (vol. 59, no. 1). — P. 134—142. — doi:10.1083/jcb.59.1.134. — PMID 4201706.
- Capo C., Garrouste F., Benoliel A. M., Bongrand P., Ryter A., Bell G. I. Concanavalin-A-mediated thymocyte agglutination: a model for a quantitative study of cell adhesion (англ.) // Journal of Cell Science : journal. — The Company of Biologists, 1982. — August (vol. 56). — P. 21—48. — PMID 7166565.
- Weiser M. M. Concanavalin A agglutination of intestinal cells from the human fetus (англ.) // Science : journal. — 1972. — August (vol. 177, no. 4048). — P. 525—526. — doi:10.1126/science.177.4048.525. — . — PMID 5050484.
- Cuatrecasas P. Interaction of wheat germ agglutinin and concanavalin A with isolated fat cells (англ.) // Biochemistry : journal. — 1973. — March (vol. 12, no. 7). — P. 1312—1323. — doi:10.1021/bi00731a011. — PMID 4696755.
- Weiss A., Shields R., Newton M., Manger B., Imboden J. Ligand-receptor interactions required for commitment to the activation of the interleukin 2 gene (англ.) // Journal of Immunology : journal. — 1987. — April (vol. 138, no. 7). — P. 2169—2176. — PMID 3104454.
- Kanellopoulos J. M., De Petris S., Leca G., Crumpton M. J. The mitogenic lectin from Phaseolus vulgaris does not recognize the T3 antigen of human T lymphocytes (англ.) // European Journal of Immunology : journal. — 1985. — May (vol. 15, no. 5). — P. 479—486. — doi:10.1002/eji.1830150512. — PMID 3873340.
- Ofek I., Mirelman D., Sharon N. Adherence of Escherichia coli to human mucosal cells mediated by mannose receptors (англ.) // Nature : journal. — 1977. — February (vol. 265, no. 5595). — P. 623—625. — doi:10.1038/265623a0. — . — PMID 323718.
- Doyle R. J., Birdsell D. C. Interaction of concanavalin A with the cell wall of Bacillus subtilis (англ.) // American Society for Microbiology : journal. — 1972. — February (vol. 109, no. 2). — P. 652—658. — PMID 4621684.
- West C. M., McMahon D. Identification of concanavalin A receptors and galactose-binding proteins in purified plasma membranes of Dictyostelium discoideum (англ.) // The Journal of Cell Biology : journal. — 1977. — July (vol. 74, no. 1). — P. 264—273. — doi:10.1083/jcb.74.1.264. — PMID 559679.
- Yu M., Sato H., Seiki M., Thompson E. W. Complex regulation of membrane-type matrix metalloproteinase expression and matrix metalloproteinase-2 activation by concanavalin A in MDA-MB-231 human breast cancer cells (англ.) // Cancer Research : journal. — American Association for Cancer Research, 1995. — August (vol. 55, no. 15). — P. 3272—3277. — PMID 7614461.
- Saleemuddin M., Husain Q. Concanavalin A: a useful ligand for glycoenzyme immobilization--a review (англ.) // Enzyme and Microbial Technology : journal. — 1991. — April (vol. 13, no. 4). — P. 290—295. — doi:10.1016/0141-0229(91)90146-2. — PMID 1367163.
Ссылки
- Конканавалин А. Иммунология. Дата обращения: 10 января 2020.
- Concanavalin A structure (англ.)
- World of Lectin, Gateway to lectins (англ.)