Колхициновые алкалоиды
Строение колхициновых алкалоидов
К колхициновым алкалоидам относятся около 30 соединений, имеющих общую структуру и отличающихся заместителями в кольце A (гидроксильные, метокси- и метилендиоксигруппы), кольце C (гидроксильные, метоксигруппы), заместителями аминогруппы кольца B (без заместителей, метильная, ацетильная, формильная и иные группы:
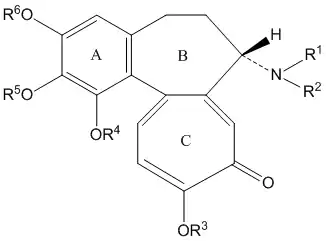
Известные представители:
- колхицин
- колхамин
- демеколцин
Химические свойства
Химические свойства колхициновых алкалоидов обусловлены наличием в составе их молекул трополонового цикла С. В частности, метоксигруппа этого цикла может легко гидролизоваться в растворах кислот и щелочей либо замещаться на H2N-, HS- и другие функциональные группы. Гидролиз метоксигруппы приводит к замене OR3-группы на OH-группу и образованию двух таутомерных спиртов. Соответственно, дальнейшее метилирование этих спиртов приведёт к образованию двух таутомерных эфиров.
Нахождение в природе
Колхициновые алкалоиды находят в растениях семейства лилейных, в частности, в растениях родов безвременник (лат. Colchicum), мерендера (лат. Merendera lamont), глориоза (лат. Gloriosa). В природе они образуются в основном из тирозина и фенилаланина через гомоморфинандиеноновые основания. Их наличие обусловило использование безвременников как лекарственных растений с древнейших времён.
Получение
Колхициновые алкалоиды получают из растений. Колхицин и его производные получают синтетическим путём.
Применение
Колхицин и его салицилат используются для купирования приступов подагры и суставного ревматизма. Колхициновые алкалоиды являются митотическими ядами, что позволило использовать их как полиплоидирующие вещества в биологии (колхиплоидия). Колхамин применяется в медицине как противоопухолевое средство.
Литература
- Даффа реакция — Меди// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1990. — Т. 2. — 671 с.