Клаудин
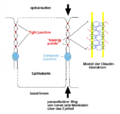
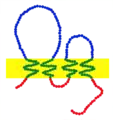
Клаудины представляют собой семейство белков, которые являются наиболее важными компонентами плотных (замыкающих) контактов, где они устанавливают параклеточный барьер, который контролирует потоки молекул в межклеточном пространстве между клетками эпителия. Они имеют четыре трансмембранных домена, две внеклеточных и одну внутриклеточную петлю и находящиеся в цитоплазме N-конец и С-конец.
Структура
Клаудины — небольшие (20-27 кДа) трансмембранные белки, которые имеются у многих организмов, начиная от нематод и кончая человеком, и очень похожи по своей структуре, хотя эта консервативность не касается их первичной структуры и генов. Молекула клаудина четырежды пересекает клеточную мембрану, её N-конец и С-конец расположены в цитоплазме; имеется две внеклеточных петли, для которых характерна наиболее высокая степень консервативности. Первая внеклеточная петля состоит в среднем из 53 аминокислот, а вторая, будучи немного меньше, из 24 аминокислот. N-концевой участок, как правило, очень короткий (4-10 аминокислот), С-концевая последовательность варьирует в длину от 21 до 63 аминокислотных остатков и необходима для локализации этих белков в плотных контактах. Предполагается, что остатки цистеина в молекулах некоторых разновидностей клаудинов формирует дисульфидную связь. Все человеческие клаудины (за исключением клаудина 12) имеют домены, которые позволяют им связывать PDZ-домены «каркасных» белков.
История
Название «клаудины» было дано этому семейству белков в 1998 году японскими исследователями Микио Фурузе и Чойширо Тсукито из университете Киото. Название «клаудин» происходит от латинского слова claudere («закрыть»), что соответствует барьерной роли этих белков.
Гены
У человека семейство клаудинов представлено 24-я белками: CLDN1, CLDN2, CLDN3, CLDN4, CLDN5, CLDN6, CLDN7, CLDN8, CLDN9, CLDN10, CLDN11, CLDN12, CLDN13, CLDN14, CLDN15, CLDN16, CLDN17, CLDN18, CLDN19, CLDN20, CLDN21, CLDN22, CLDN23