Долговременный эксперимент по эволюции E. coli
Долговременный эксперимент по эволюции E. coli — уникальный эксперимент по эволюции бактерии Escherichia coli в искусственных условиях, проводимый группой под руководством Ричарда Ленски в университете штата Мичиган. В процессе эксперимента прослежены генетические изменения, происходившие в 12 популяциях E. coli на протяжении более чем 60000 поколений. Эксперимент начался 24 февраля 1988 года и продолжается более 30 лет[1][2].

За время эксперимента обнаружен широкий спектр генетических изменений. Наиболее значительными адаптациями стали появившаяся у одной из популяций способность усваивать цитрат натрия, а также возникновение полиморфных сообществ путём разделения колонии на отдельные сосуществующие и самостоятельно эволюционирующие популяции.
Цель эксперимента
Целью эксперимента был поиск ответа на некоторые важные вопросы эволюционной биологии[3]:
- Каким образом меняется во времени скорость эволюционных изменений;
- Какова повторяемость эволюционных изменений для различных популяций, существующих в одинаковой среде;
- Каково соотношение эволюции на генотипическом и фенотипическом уровнях.
Методика эксперимента
Выбор бактерии E. coli объясняется быстрой сменой поколений у этого организма и небольшим размером генома, что позволяет за короткий период времени исследовать процессы, которые у более сложных организмов занимают тысячелетия. Благодаря тому, что эта бактерия десятилетиями используется в молекулярной биологии, она хорошо исследована, технологии работы с ней хорошо отлажены. Бактерия без потери жизнеспособности может длительно сохраняться в замороженном состоянии, что позволяет вести своеобразную «летопись эксперимента», а размораживание нужного поколения позволит при необходимости повторить эксперимент с любой ранее сохранённой точки.
В качестве предкового штамма E. coli был взят «штамм Bc251», описанный в 1966 году Сеймуром Ледербергом[4] и использованный Брюсом Левиным в экспериментах по бактериологической экологии в 1972 году. Характерными чертами этого штамма были T6r (устойчивость к бактериофагу T6), Strr (устойчивость к стрептомицину), r−m− (рестрикционная и модификационная активности выключены), Ara− (неспособность усваивать арабинозу)[5]. Перед началом эксперимента путём точечной мутации оперона ara Ленски подготовил вариант Ara+ этого штамма, способный усваивать арабинозу.
В начале эксперимента были созданы 12 популяций исходного штамма (6 популяций Ara+ и 6 Ara−, получившие обозначение A+1 … A+6 и A−1 … A−6 соответственно). Для точной идентификации каждой популяции были задействованы генетические маркеры. Каждая популяция размножалась в искусственной среде, где скорость размножения ограничивалась стрессовыми условиями (недостатком основного продукта питания — глюкозы). Каждый день 0,1 мл содержимого каждой пробирки переносилось в пробирку с 10 мл свежей питательной среды, где размножение бактерий продолжалось. Каждое 500-е поколение (что соответствует интервалу в 75 дней) замораживалось в глицерине при температуре −80 °C, чтобы в будущем с появлением новых методов анализа имелась возможность провести более подробное исследование. По ходу эксперимента полностью секвенировался геном предкового штамма, а также геномы некоторых этапных поколений (поколения 2000, 5000, 10 000, 15 000, 20 000 и 40 000)[6].
Поскольку размер генома E. coli составляет 4,6 млн нуклеотидных пар, то при наблюдаемой скорости мутаций (около 1000 замен нуклеотидных пар в день), каждая пара нуклеотидов в геноме за 20 лет заменяется в среднем более одного раза[7]. Не все мутации, возникающие в геноме, равнозначны. Полезность мутации определяется скоростью размножения их носителей. Повышенная скорость размножения позволяет мутировавшей бактерии вытеснять из популяции бактерии с отсутствующей мутацией. При этом мутация «фиксируется» и присутствует в геноме всех последующих поколений. Вредные мутации действуют противоположным образом. Существуют также «нейтральные» мутации, которые не влияют на скорость размножения бактерий, так как возникают в незначимых участках генома. Эти мутации не фиксируются и не подавляются отбором и, таким образом, появляются и исчезают случайным образом.
В эксперименте использовалась линия E. coli, размножающаяся исключительно делением (без полового процесса). Таким образом, круг исследуемых явлений ограничивался вновь возникшими мутациями[3].
Питательная среда DM25
В эксперименте использовалась минимальная питательная среда Дэвиса[8] с концентрацией глюкозы 25 мг/л, обозначаемая как DM25. Эта среда обеспечивает в стационарной фазе плотность 50 млн бактерий/мл[9].
Объём культуры составлял 10 мл. Культуры содержались в 50-миллилитровых конических колбах, свободно накрытых перевёрнутыми стеклянными стаканами. Инкубация происходила при температуре 37 °С и скорости вращения 120 об/мин. По прошествии суток 0,1 мл культуры переносился в колбу с 9,9 мл свежей среды.
Состав среды DM25 (на 500-миллилитровый флакон) следующий:
| Компонент | Формула | Объём | Масса | Приготовление |
|---|---|---|---|---|
| Гидрофосфат калия | K2HPO4 · 3H2O | 3,5 г | Приготовить раствор и автоклавировать | |
| Дигидрофосфат калия | KH2PO4 · H2O | 1,0 г | ||
| Сульфат аммония | (NH4)2SO4 | 0,5 г | ||
| Цитрат натрия | Na3C6H5O7 | 0,25 г | ||
| Вода | H2O | 500 мл | ||
| Глюкоза (10 %) | C6H12O6 | 0,125 мл | 12,5 мг | После автоклавирования добавить из стерильных флаконов |
| Сульфат магния (10 %) | MgSO4 | 0,5 мл | 25 мг | |
| Тиамин (0,2 %) | C12H17N4OS | 0,5 мл | 25 мг |
Следует отметить, что обычно бактерии E. coli не потребляют цитрат натрия, он используется только как хелатор железа.
Результаты эксперимента
Частота мутаций
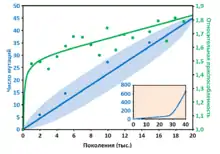
В работе[2] приводятся результаты исследования популяции A-1, одной из 12, участвовавших в эксперименте. Авторы разделяют эволюцию популяции на два этапа, граница между которыми примерно приходится на поколение 26 000.
При секвенировании генома поколения 20 000 и сравнении его с геномом исходного штамма были обнаружены 45 фиксированных мутаций разного типа (замена нуклеотидов, вставки, замены, инверсии, встраивание мобильных элементов), из которых основная масса (29) пришлась на однонуклеотидные замены. Скорость накопления фиксированных мутаций в течение первого этапа эксперимента оставалась примерно постоянной. Неожиданным оказалось то, что приспособленность бактерий к среде, выражавшаяся в скорости размножения, до поколения 1500 росла очень быстро, затем её рост замедлился при прежней скорости фиксирования мутаций.
В других популяциях за первые 20 000 поколений менее 100 фиксированных мутаций, из которых полезными были только от 10 до 20[3].
Картина эволюционных изменений в популяции А-1 кардинально изменилась после поколения 26 000. В этот момент произошла мутация в гене mutT, который кодирует белок, участвующий в репарации ДНК. В результате этого среднее число фиксированных мутаций резко возросло до 0,05 за поколение (по сравнению с 0,002 на первом этапе). Всего в поколениях 20 000—40 000 зафиксировалось 609 мутаций. Аналогичное увеличение скорости мутагенеза наблюдалось в трёх других популяциях из 12.
Изменения в метаболизме

Неожиданным оказался результат эволюции популяции А-3. В момент, соответствующий поколению 33 127, в колбе было замечено сильное помутнение, свидетельствующее о высокой плотности бактерий. Подобный эффект обычно наблюдался при загрязнении культуры бактериями другого вида, потребляющими цитрат натрия. Поскольку концентрация цитрата натрия в среде (500 мг/л) в 20 раз превышает концентрацию глюкозы (25 мг/л), потребление цитрата обеспечивает значительно более высокую плотность клеток[7].
Неспособность питаться цитратами в кислородной среде является характерной особенностью E. coli. Тем не менее, исследование показало, что цитрат натрия потребляют именно мутантные бактерии E. coli (Cit+-бактерии). Проверка генетических маркеров, а также наличие мутаций pykF и nadR, характерных для предыдущих поколений А-3, подтвердили, что бактерии Cit+ не привнесены извне, а являются мутировавшими особями исходного штамма[7].
Ретроспективное обследование замороженных образцов показало, что в поколении 31 000 бактерий Cit+ нет вообще, в поколении 31 500 они составляют 0,5 %, в поколениях 32 000 и 32 500 — 15 и 19 % соответственно. В поколении 33 000 Cit+ практически исчезают (1,1 %), однако в поколении 33 500 так же неожиданно отвоёвывают жизненное пространство и в последующих поколениях полностью доминируют. Исследователи объясняют это появлением между поколениями 33 000 и 33 500 некоторой пока не установленной мутации, которая в сочетании со способностью питаться цитратом обеспечило бактериям Cit+ эволюционное преимущество[7].
Была проверена гипотеза о том, что способность усваивать цитрат (хотя и менее эффективно, чем глюкозу) имелась у бактерий изначально, однако до возникновения сопутствующих мутаций это качество явно не проявлялось. Гипотеза не подтвердилась, так как бактерии до 31 000-го поколения оказались неспособны размножаться в среде без глюкозы[7].
Возникновение полиморфных сообществ
К 2017 году, когда эксперимент продолжался уже 29 лет, неожиданно обнаружилось, что в 9 популяциях из 12 произошла экологическая диверсификация. Исходная монокультура разделилась на отдельные популяции, которые продолжали эволюционировать отдельно, не вытесняя друг друга[10][11].
Первоначальной задачей эксперимента являлось наблюдение за эволюцией бактериального сообщества в предельно простых обстоятельствах — в постоянной среде, при наличии единственного источника пищи, без генетического обмена и экологического взаимодействия между организмами. Однако со временем произошло спонтанное усложнение популяции с появлением раздельных экологических ниш. Простейший пример такого рода разделения — образование двух микробных сообществ, каждое из которых имеет свой тип обмена веществ, где используются продукты жизнедеятельности другого сообщества. Впервые этот эффект замечен в 2014 году на одной из популяций (Ara-2)[12], а к 2017 году обнаружен в 9 популяциях из 12. При этом продолжается обычная адаптивная эволюция, наблюдавшаяся во всех популяциях с самого начала эксперимента, однако теперь эта эволюция происходит не в масштабах популяции в целом, а в каждом из бактериальных сообществ. В этих условиях скорость размножения бактерий как показатель степени приспособленности частично теряет смысл, так как приспособленность теперь зависит от эффективности взаимодействия с другими сообществами.
Было замечено, что на ранних и поздних этапах адаптации наиболее интенсивная фиксация мутаций происходила в разных генах. Этот феномен объясняется тремя факторами:
- Быстрее фиксируются мутации, сразу дающие заметный прирост приспособленности организма.
- Уже зафиксированные мутации меняют степень полезности других мутаций. Некоторые мутации становятся полезными только если предварительно сформировался определённый генетический контекст.
- С появлением в популяции отдельных бактериальных сообществ бактерии начинают приспосабливаться не к простой и стабильной среде, а к динамичному экологическому окружению.
Таким образом, эксперимент разрушил прежние представления об адаптации бесполой популяции к стабильным условиям среды. Вопреки ожиданиям, замедления адаптивной эволюции практически не происходит, а по достижении определённой степени приспособленности популяции к среде возникает спонтанное усложнение структуры популяции.
Примечания
- Richard E. Lenski Source of founding strain, 2000. Accessed June 18, 2008.
- Jeffrey E. Barrick, Dong Su Yu, Sung Ho Yoon, Haeyoung Jeong, Tae Kwang Oh, Dominique Schneider, Richard E. Lenski, Jihyun F. Kim. Genome evolution and adaptation in a long-term experiment with Escherichia coli (англ.) // Nature : journal. — 2009. — Vol. 461. — P. 1243—1247. Обзор на русском языке: Марков А. Подведены итоги эволюционного эксперимента длиной в 40 000 поколений. Элементы, 02.11.2009.
- Lenski, Richard E. Phenotypic and genomic evolution during a 20,000-generation experiment with the bacterium Escherichia coli (англ.) // Plant Breeding Reviews : journal. — 2004. — Vol. 24, no. 2. — P. 225—265.
- Lederberg, S. (1966) Genetics of host-controlled restriction and modification of deoxyribonucleic acid in Escherichia coli. Journal of Bacteriology, 91(3): 1029—1036.
- Richard E. Lenski, Source of founding strain, 2000. Accessed 18 June 2008.
- Richard E. Lenski, Overview of the E. coli long-term evolution experiment, 2000.
- Blount, Zachary D.; Christina Z. Borland, Richard E. Lenski. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2008. — 10 June (vol. 105, no. 23). — P. 7899—7906. — doi:10.1073/pnas.0803151105. — PMID 18524956.. HTML
- Carlton B. C., Brown B. J. (1981) Gene mutation. In: Gerherdt P., editor. Manual of methods for general bacteriology. Washington (D. C.): American Society for Microbiology. P. 222—242. Русский перевод: Кэрлтон Б., Браун Б. Мутации. В кн: Методы общей бактериологии: Пер. с англ./Под ред. Ф. Герхардта и др. — М.: Мир, 1984. — 472 с., ил.
- Все материалы данного раздела, кроме фрагментов, где источник указан особо, взяты с сайта проекта: DM25 Liquid Medium.
- Benjamin H. Good, Michael J. McDonald, Jeffrey E. Barrick, Richard E. Lenski, Michael M. Desai. The dynamics of molecular evolution over 60,000 generations // Nature. Published online 18 October 2017. doi:10.1038/nature24287.
- Марков А. В долгосрочном эксперименте Ричарда Ленски из исходно одинаковых бактерий сформировались полиморфные сообщества // Элементы, 22.10.2107.
- J. Plucain et al., 2014. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli.
См. также
Ссылки
- Richard E. Lenski Hannah Distinguished Professor Michigan State University — Страничка Ричарда Ленски на сайте Университета штата Мичиган. Здесь стоит динамический счётчик, который показывает, сколько поколений бактерий сменилось в продолжающемся эксперименте по эволюции E. coli. На 15 апреля 2016 года — 64 770 поколений.
- Bacteria make major evolutionary shift in the lab Bob Holmes New Scientist 09 June 2008
- E. coli Long-term Experimental Evolution Project Site
- Evolution: Past, Present and Future Richard Lenski
- List of publications on the experiment
- Генетические мутации ускоряют сами себя.
- J. Lederberg Isolation and Characterization of Biochemical Mutants of Bacteria.
- В долгосрочном эволюционном эксперименте выявлен отбор на «эволюционную перспективность»